Tantal(V)-iodid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Ta5+ _ I− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tantal(V)-iodid | |||||||||||||||
| Andere Namen |
Tantalpentaiodid | |||||||||||||||
| Verhältnisformel | TaI5 | |||||||||||||||
| Kurzbeschreibung |
schwarzer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 815,47 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
5,8 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
543 °C[1] | |||||||||||||||
| Löslichkeit |
reagiert mit Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Tantal(V)-iodid ist eine anorganische chemische Verbindung des Tantals aus der Gruppe der Iodide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Tantal(V)-iodid kann durch Reaktion von Tantal mit Iod gewonnen werden.[3]
Ebenfalls möglich ist die Darstellung Tantal(V)-oxid und Aluminium(III)-iodid.[3]
Eigenschaften
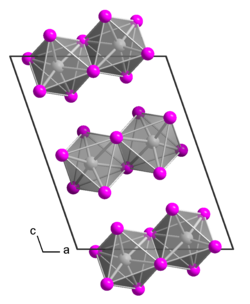
[Bearbeiten | Quelltext bearbeiten]Tantal(V)-iodid ist ein sehr feuchtigkeitsempfindlicher Feststoff, der in Form von glänzenden schwarze bis bronzefarbene Blättchen oder Nadeln vorliegt. Es sind zwei Modifikationen bekannt, die sich allein in der Stapelfolge der (TaI5)2-Dimere unterscheiden. Die erste Modifikation hat eine orthorhombische Kristallstruktur mit der Raumgruppe Pnma (Nr. 62), die zweite besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14) mit 4 Formeleinheiten in der Elementarzelle.[4] Bei 1000 °C zersetzt sich die Verbindung unter Iodabgabe.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Datenblatt Tantalum(V) iodide, ≥99.9% bei Sigma-Aldrich, abgerufen am 12. Mai 2017 (PDF).
- ↑ W. M. Haynes, David R. Lide, Thomas J. Bruno: CRC Handbook of Chemistry and Physics 2012-2013. CRC Press, 2012, ISBN 978-1-4398-8049-4, S. 4–93 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1455.
- ↑ Katja Habermehl: Neue Untersuchungen an Halogeniden des Niobs und Tantals. Inaugural-Dissertation, Köln 2010 (Mathematisch-Naturwissenschaftliche Fakultät, Universität Köln, urn:nbn:de:hbz:38-31032).
- ↑ Dale L. Perry: Handbook of Inorganic Compounds. 2. Auflage. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 411 (eingeschränkte Vorschau in der Google-Buchsuche).




