Nickel(II)-chromat
Zur Navigation springen
Zur Suche springen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
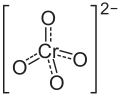
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nickel(II)-chromat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | NiCrO4 | |||||||||||||||
| Kurzbeschreibung |
grüner geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 174,68 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
4,2 g·cm−3[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
löslich in Wasser[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Nickelchromat ist eine anorganische chemische Verbindung des Nickels aus der Gruppe der Chromate.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Nickelchromat kann durch Reaktion von Nickel(II)-carbonat mit Chromtrioxid bei 260 °C gewonnen werden.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Nickelchromat ist als Hydrat ein kristalliner grüner geruchloser Feststoff,[1] der löslich in Wasser ist.[3] Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Cmcm (Raumgruppen-Nr. 63).[2][6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Nickelchromat wird als Katalysator verwendet.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Eintrag zu CAS-Nr. 14721-18-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Juli 2016. (JavaScript erforderlich)
- ↑ a b springer.com: NiCrO4 (Ni[CrO4) Crystal Structure - SpringerMaterials], abgerufen am 10. Juli 2016
- ↑ a b Datenblatt Nickel(II) chromate hydrate, 98% bei Alfa Aesar, abgerufen am 10. Juli 2016 (Seite nicht mehr abrufbar).
- ↑ Eintrag zu Nickel chromate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Friend, J. Newton: A text-book of inorganic chemistry, Volume VI, Part III, Chromium and its Congeners, abgerufen am 10. Juli 2016.
- ↑ iaea.org: Table of Magnetic Structures Determined by Neutron Diffraction, A.Olos, F.Kajzar, M.Kuceb, abgerufen am 10. Juli 2016
- ↑ Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 274 (eingeschränkte Vorschau in der Google-Buchsuche).
Kategorien:
- Sensibilisierender Stoff
- Krebserzeugender Stoff
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Nickelverbindung
- Chromat
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 27
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 47
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 28
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 72



