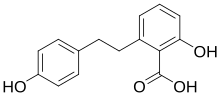
Lunularsäure
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Lunularsäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C15H14O4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 258,27 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt |
201–202 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Die Lunularsäure ist eine organische Säure aus der Gruppe der Phenolcarbonsäuren und weist eine 2,6-Kresotinsäure-Untereinheit auf.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Untersuchungen zum Vorkommen phenolischer Verbindungen bei niederen Pflanzen wurden am Beispiel der Lebermoose erstmals im Jahr 1966 durchgeführt und in den Folgejahren fortgeführt.[3][4][5] 1996 wurde erstmalig die Lunularsäure aus dem Mondbechermoos isoliert.[6] Bei Untersuchungen der Chemie der Moose wurde die Verbindung 1971 auch im Lebermoos gefunden.[7][8]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Die organische Verbindung kommt in Lebermoosen, wie zum Beispiel im Alpen-Brunnenlebermoos (Marchantia alpestris Nees) und im Mondbechermoos (Lunularia cruciata (L.) DUM) vor.[8] Vereinzelt ist sie auch in Laubmoosen und häufig in Algen zu finden.[1]
Synthese
[Bearbeiten | Quelltext bearbeiten]Frühe Synthesen der Lunularsäure waren sehr aufwändig bei einer geringen Gesamtausbeute.[9][10]
1988 wurde eine Synthese im Labormaßstab unter Verwendung gut zugänglicher Ausgangsstoffe mit einer Gesamtausbeute von 50 % über 3 bis 6 Stufen publiziert.[11] Diese geht von 6-Methylsalicylsäureethyester – zugänglich in einer zweistufigen Sequenz aus Acetessigester und Crotonaldehyd – aus, der bereits das vicinale 1,2,3-Substitutionsmuster der Lunularsäure aufweist.
Zunächst wird die Hydroxygruppe als Methylether oder Acetat geschützt. Im Anschluss wird die 6-Methylgruppe mit verschiedenen Methoden funktionalisiert und in das Diphenylethan-System überführt.
Dies kann beispielsweise über eine Metallierung des 6-Methylethers und die anschließende Alkylierung durch p-Methoxybenzylchlorid passieren. Das Zwischenprodukt ist der OH-geschützte Lunularsäureethylester, der nach der Esterverseifung und einer Demethylierung mittels Bortribromid in die Lunularsäure überführt wird.
Weitere Synthesen
[Bearbeiten | Quelltext bearbeiten]- 1997: Synthese über eine modifizierte Suzuki-Reaktion[12]
- 1998: Totalsynthese der Naturstoffe beziehungsweise. Naturstoffderivate Lunularsäure, Lunularin und weiterer verwandter Verbindungen als potentielle Inhibitoren der Arachidonsäurekaskade[13]
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]In niederen Pflanzen fungiert sie als Wachstumsregulator.[8] Einige ihrer Derivate haben außerdem eine stark molluskizide Wirkung.[1] Die Lunularsäure selbst und prenylierte Diphenylethan-Derivate, die sich von ihrem Strukturtyp ableiten, weisen im Allgemeinen eine hohe antibakterielle Aktivität auf.[11]
Nachweis
[Bearbeiten | Quelltext bearbeiten]Die Phenolcarbonsäure kann mittels Dünnschichtchromatografie auf Kieselgel oder Gaschromatografie auf XE-60 sowie OV-17-Säulen identifiziert werden.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu Lunularsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2024.
- ↑ a b Sicherheitsdatenblatt. 2-Hydroxy-6-(4-hydroxyphenethyl)benzoic acid. BLD Pharmatech, 15. November 2023, abgerufen am 14. Juni 2024.
- ↑ "Beitrag zur Phytochemie der Hepaticae" R. Mues and H. D. Zinsmeister: Österreichische Botanische Zeitschrift (1973), S. 151–154.
- ↑ R. Mues, H. D. Zinsmeister: Beitrag zur Phytochemie der Hepaticae. In: Österreichische botanische Zeitschrift. Band 121, Nr. 1, 1973, S. 151–154, doi:10.1007/BF01373374.
- ↑ H. Reznik, R. Wiermann: Quercetin und Kämpferol im Thallusgewebe vonCorsinia coriandrina. In: Naturwissenschaften. Band 53, Nr. 9, 1966, S. 230–231, doi:10.1007/BF00633905.
- ↑ I. F. M. Valio, R. S. Burdon, W. W. Schwabe: New Natural Growth Inhibitor in the Liverwort Lunularia cruciata (L) Dum. In: Nature. Band 223, Nr. 5211, 1969, S. 1176–1178, doi:10.1038/2231176a0.
- ↑ R. J. Pryce: Lunularic acid, a common endogenous growth inhibitor of liverworts. In: Planta. Band 97, Nr. 4, 1971, S. 354–357, doi:10.1007/BF00390214.
- ↑ a b c d Siegfried Huneck, R. J. Pryce: Inhaltsstoffe der Moose, IX. Lunularsäure aus Marchantia alpestris / Constituents of Liverworts and Mosses, IX. Lunularic Acid from Marchantia alpestris. In: Zeitschrift für Naturforschung B. Band 26, Nr. 7, 1971, S. 738–738, doi:10.1515/znb-1971-0726.
- ↑ Siegfried Huneck, Klaus Schreiber: Synthese der lunularsäure. In: Phytochemistry. Band 16, Nr. 7, 1977, S. 1013–1016, doi:10.1016/s0031-9422(00)86712-6.
- ↑ Yoshitsugu Arai, Tadao Kamikawa, Takashi Kubota, Yoshio Masuda, Ryoichi Yamamoto: Synthesis and properties of lunularic acid. In: Phytochemistry. Band 12, Nr. 9, 1973, S. 2279–2282, doi:10.1016/0031-9422(73)85134-9.
- ↑ a b Theophil Eicher, Kristin Tiefensee, Rigobert Pick: Synthese von Bryophyten-Inhaltstoffen 1. Neue Synthesen der Lunularsäure und einiger ihrer Derivate. In: Synthesis. Band 1988, Nr. 07, 1988, S. 525–529, doi:10.1055/s-1988-27624.
- ↑ Ekaterini Nikolakis: Modifizierte SUZUKI-Reaktion: Anwendung auf die Synthese von Combretastatin A-4, A-5 und Lunularsäure; zur Synthese des Brefeldin C-Gerüsts via RCM. Dissertation. Dortmund 1997.
- ↑ Jürgen Krauss: Totalsynthese der Naturstoffe bzw. Naturstoffderivate Secocurvularin, Curvulin, Lunularsäure, Lunularin, (R)-Zearalan, (S)-Zearalan, Zeranol und (R)-Zearalanon und verwandter Verbindungen als potentielle Inhibitoren der Arachidonsäurekaskade. Dissertation. Braunschweig 1998.

