Flavanone

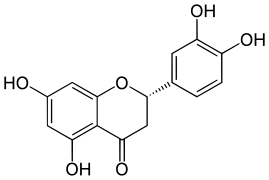
Die Flavanone sind eine Untergruppe sekundärer Pflanzenstoffe innerhalb der Stoffgruppe der Flavonoide. Sie unterscheiden sich strukturell von dem ihnen zugrunde liegenden Flavan durch eine zusätzliche Ketogruppe in Position 4. Das Grundgerüst der Flavanone ist somit die Verbindung Flavan-4-on.
Struktur
[Bearbeiten | Quelltext bearbeiten]Die Flavanone besitzen ein Chiralitätszentrum am Kohlenstoffatom C2, so dass es zu einer Konstitutionsformel immer zwei mögliche Konfigurationen gibt: (2S), (2R).[1] Dabei ist die (2S)-Konfiguration bei weitem die gängigste Konfiguration und wird als die natürliche Konfiguration angesehen.[1]
Die einzelnen Flavanone unterscheiden sich voneinander durch das Substitutionsmuster des Flavan-4-on-Grundgerüsts mit Hydroxygruppen und durch die Art der weiteren Derivatisierung dieser hydroxylierten Flavan-4-one durch u. a. O-Alkylierung, meist in der Form von O-Methylierung und/oder durch die O-glycosidische Anbindung von Saccharid-Resten unter Bildung von Glycosiden.[1][2]
Nicht-glycosylierte Flavanone
[Bearbeiten | Quelltext bearbeiten]Typische und häufiger vorkommende Flavanone sind Naringenin und Eriodictyol. Sie tragen an den Kohlenstoffatomen in den Positionen 5, 7 und 4' bzw. 5, 7, 3' und 4' Hydroxygruppen. Auch Isosakuranetin und Hesperetin, die sich von diesen Flavanonen durch Methylierung der Hydroxygruppe an C4' ableiten, sind gängig.
-
Naringenin
-
Eriodictyol
-
Isosakuranetin
-
Hesperetin
| Name | Konfig. C2 | 5 | 6 | 7 | 8 | 2′ | 3′ | 4′ | 5′ | 6′ | CAS |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Blumeatin | (2S) | OH | OMe | OH | OH | 118024-26-3 | |||||
| (−)–Butin | (2S) | OH | OH | OH | 492-14-8 | ||||||
| (+)–Eriodictyol | (2S) | OH | OH | OH | OH | 552-58-9 | |||||
| Hesperetin | (2S) | OH | OH | OH | OMe | 520-33-2 | |||||
| Homoeriodictyol | (2S) | OH | OH | OMe | OH | 446-71-9 | |||||
| Isosakuranetin | (2S) | OH | OH | OMe | 480-43-3 | ||||||
| Liquiritigenin | (2S) | OH | OH | 578-86-9 | |||||||
| Naringenin | (2S) | OH | OH | OH | 480-41-1 | ||||||
| (+)–Pinocembrin | (2S) | OH | OH | 480-39-7 | |||||||
| Sakuranetin | (2S) | OH | OMe | OH | 2957-21-3 | ||||||
| Sternbin | (2S) | OH | OMe | OH | OH | 51857-11-5 | |||||
In den Spalten 5–6' sind die Substituenten der jeweiligen Positionen des Flavan-4-on-Grundgerüsts der Flavanone angegeben: | |||||||||||
Glycosylierte Flavanone
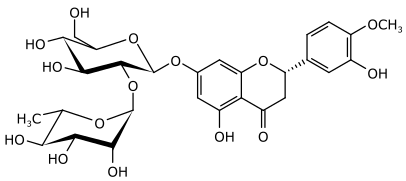
[Bearbeiten | Quelltext bearbeiten]In den O-Glycosiden der Flavanone sind die Saccharidreste häufig an das Kohlenstoffatom in Position 7 angebunden. Häufiger sind die beiden Disaccharide Rutinose bzw. Neohesperidose gebunden. Hesperetin bildet durch Anbindung dieser beiden Disaccharide in Position 7 die beiden isomeren Glycoside Hesperidin und Neohesperidin.
-
Hesperidin
-
Neohesperidin
| Glycosid | Aglycon | Konfig. C2 | 5 | 6 | 7 | 8 | 2′ | 3′ | 4′ | 5′ | 6′ | CAS |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Eriocytrin | Eriodictyol | (2S) | OH | Rutinosyl | OH | OH | 13463-28-0 | |||||
| Didymin | Isosakuranetin | (2S) | OH | Rutinosyl | OMe | 14259-47-3 | ||||||
| Hesperidin | Hesperetin | (2S) | OH | Rutinosyl | OH | OMe | 520-26-3 | |||||
| Narirutin | Naringenin | (2S) | OH | Rutinosyl | OH | 14259-46-2 | ||||||
| Naringin | Naringenin | (2S) | OH | Neohesperidosyl | OH | 10236-47-2 | ||||||
| Neohesperidin | Hesperetin | (2S) | OH | Neohesperidosyl | OH | OMe | 13241-33-3 | |||||
| Poncirin | Isosakuranetin | (2S) | OH | Neohesperidosyl | OMe | 14941-08-3 | ||||||
| Sakuranin | Sakuranetin | (2S) | Glucosyl | OMe | OH | 529-39-5 | ||||||
In den Spalten 5–6' sind die Substituenten der jeweiligen Positionen des Flavan-4-on-Grundgerüsts der Flavanone angegeben: | ||||||||||||
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Flavanone sind in höheren Pflanzen weit verbreitet und wurden in etwa 42 Familien nachgewiesen. Sie kommen insbesondere in Pflanzenarten aus den Familien Korbblütler, Hülsenfrüchtler und Rautengewächse, z. B. in der Gattung der Zitruspflanzen vor.[3]
Die Schalen von Zitrusfrüchten enthalten größere Mengen an Flavanon-Glycosiden, wobei die getrockneten Schalen von Grapefruits und Satsumas jeweils über 3 % Flavanon-Glycoside enthalten. Diese bestehen bei Grapefruits neben etwas Narirutin praktisch ausschließlich aus Naringin. Bei Satsumas bestehen diese zu etwa 2/3 aus Hesperidin, zu etwa 1/3 aus Narirutin und wenig Naringin. Naringenin und Hesperetin, die entsprechenden Aglycone dieser Glycoside wurden jeweils nicht gefunden.[4]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Die Flavanone werden durch einen intramolekularen Ringschluss aus den entsprechenden Chalkonen gebildet. Die Michael-Addition innerhalb des Chalkons erfolgt enantioselektiv und wird durch Chalkon-Isomerasen katalysiert.[5][3] Dabei entsteht aus Naringenin-Chalkon (Synonym: (E)-2',4,4',6'-Tetrahydroxychalkon) das Flavanon Naringenin (Synonym: (S)-4',5,7-Trihydroxyflavanon).[3]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Bohm B. A.: Introduction to Flavonoids - Chemistry and biochemistry of organic natural products; Volume 2, 1999, Verlag CRC Press, S. 82 ff., ISBN 90-5702-353-9
- ↑ Harborne J. B.: The Flavonoids - Advances in Research since 1980, 1988, Chapman and Hall, London, New York S. 348–372, ISBN 0-412-28770-6
- ↑ a b c Khan, M. K. et al.: A comprehensive review on flavanones, the major citrus polyphenols, Journal of Food Composition and Analysis, 2014, 33(1), S. 85–104, doi:10.1016/j.jfca.2013.11.004
- ↑ Lee, G. J. et al.: A multi-faceted comparison of phytochemicals in seven citrus peels and improvement of chemical composition and antioxidant activity by steaming LWT - Food Science and Technology, 2022, 160, 113297, doi:10.1016/j.lwt.2022.113297
- ↑ Peter Nuhn: Naturstoffchemie. 3. Auflage. S. Hirzel, Stuttgart/Leipzig 1997, ISBN 3-7776-0613-8, S. 602–604.