Warane
| Warane | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Bindenwaran (V. salvator), Malaysia (Borneo) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Familie | ||||||||||||
| Varanidae | ||||||||||||
| Merrem, 1820 | ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Varanus | ||||||||||||
| Merrem, 1820 |
Die Warane (lateinisch Varanus) bilden eine über 80 Arten[1] umfassende Gattung der Schuppenkriechtiere (Squamata) aus der Teilordnung der Schleichenartigen (Anguimorpha). Sie kommen in den tropischen und subtropischen Gebieten von Afrika, Asien und Australien vor und bewohnen eine Vielzahl von Lebensräumen. Die meisten Warane sind lang gestreckte Echsen mit spitz zulaufendem Kopf und einem langen Schwanz. Je nach Art wird eine Länge von 20 cm bis 3 m erreicht. Die größte heute lebende Echse gehört der Gattung der Warane an: der Komodowaran. Ein auffallendes Merkmal der Warane ist die lange und an der Spitze tief gespaltene Zunge; sie dient beim Züngeln der geruchlichen Wahrnehmung, welche bei Waranen der wohl wichtigste Sinn ist.
Alle Warane sind tagaktiv und verbringen die Nacht je nach Art in selbst gegrabenen Bauten, Baumhöhlen oder ähnlichen Unterschlüpfen. Die saisonale Aktivität von vielen Waranen wird von der Trockenzeit in ihren Lebensräumen geprägt. Während dieser Zeit mangelt es an Nahrung und die Warane überdauern die Trockenzeit in einem Versteck.
Es gibt sowohl bodenbewohnende und baumbewohnende als auch teils wasserbewohnende (semiaquatische) Arten. Durch besondere Anpassungen von Herz, Lunge und Ventilation können Warane weit mehr Sauerstoff als andere Schuppenkriechtiere aufnehmen, sie haben also eine effizientere Atmung und sind zu einer aktiveren Lebensweise und größerer Leistung befähigt. Die meisten Warane suchen große Gebiete züngelnd nach Beute ab. Nahezu alle Warane sind Fleischfresser und ernähren sich von Insekten, anderen Wirbellosen oder auch kleinen bis mittelgroßen Wirbeltieren. Einige Arten fressen auch Aas. Nur drei Arten auf den Philippinen fressen neben tierischer Nahrung auch zu einem großen Teil Früchte.
Einige Arten der Warane sind von hoher wirtschaftlicher Bedeutung für den Menschen und werden besonders in Afrika und Südostasien für den Lederhandel und als Fleischlieferanten gejagt. Während eine Reihe von Arten diesem Bejagungsdruck augenscheinlich standhält, verzeichnen andere kommerziell genutzte Waranarten beträchtliche Bestandseinbußen. Daneben sind Warane oft durch den Verlust ihres Lebensraumes gefährdet. In der Roten Liste gefährdeter Arten der IUCN wird eine Art als stark gefährdet eingestuft, zwei weitere Arten als gefährdet. Für die meisten Arten liegen jedoch nur unzureichende Informationen zum Gefährdungsstatus vor.[2]
Der Name Waran sowie der Gattungsname Varanus leiten sich etymologisch vom arabischen Wort ورل / waral ab, welches für Warane insgesamt steht, und von der gleichlautenden altägyptischen Bezeichnung für den Nilwaran (V. niloticus).[3]
Verbreitung und Lebensraum
[Bearbeiten | Quelltext bearbeiten]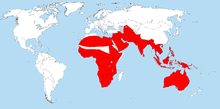
Warane leben in den Tropen, Subtropen und in geringerem Maß auch in den gemäßigten Zonen der alten Welt. Das Verbreitungsgebiet der Gattung erstreckt sich in Afrika über fast den gesamten Kontinent und reicht von dort über die arabische Halbinsel, Mittelasien, Kontinental-Südostasien und die südostasiatische Inselwelt bis nach Australien.[4] Daneben erreichen einige Arten die westlichsten Inselgruppen des Pazifiks, etwa die Salomonen, die Marshallinseln, die Karolinen und die Marianen.[5][6] Das nördlichste Vorkommen aller Warane hat der Wüstenwaran, dessen Verbreitung sich von Nordafrika und Mittelasien bis zum Aralsee und zum Kaspischen Meer auf etwa 46° nördliche Breite erstreckt.[7] Warane fehlen auf Madagaskar, Tasmanien und Neuseeland sowie in Europa, Amerika und der Antarktis.[8]
Ihre größte Diversität haben Warane in Australien; dort sind 30 Arten nachgewiesen. Stellenweise kommen bis zu elf Arten sympatrisch vor. Ein weiterer „Hotspot“ für Warane ist Neuguinea, welches fünf Arten mit Australien teilt. Auf Neuguinea, den Salomonen und dem Bismarck-Archipel zusammen sind 16 Arten von Waranen bekannt.[9][1] Auf den Molukken könnten bis zu zehn Arten vorkommen, die Zahl gilt jedoch als nicht gesichert.[10][11] Die Philippinen beherbergen acht Arten, darunter auch alle Früchte fressenden Arten der Untergattung Philippinosaurus. Seit 2010 sind drei weitere Arten aus den Philippinen beschrieben worden. Das Vorkommen des Raunackenwarans (V. rudicollis) auf den Philippinen ist nicht gesichert, zusammen wären es dann zwölf Arten.[12][13] Im übrigen malaiischen Archipel leben zwölf Arten,[1] in Kontinental-Asien sieben Arten. In Afrika schließlich gibt es fünf Arten.[14]
In ihrem großen Verbreitungsgebiet besiedeln Warane eine Vielzahl von Lebensräumen in diversen Höhenlagen, beispielsweise Regenwald, Wüste und Mangroven. Einige Arten besiedeln auch anthropogene und urbane Räume. Die tropischen Lebensräume der Warane sind durch saisonale Schwankungen geprägt. Meist lassen sich diese in eine nahrungsreiche Regenzeit und eine nahrungsarme Trockenzeit unterteilen.[4]
Merkmale
[Bearbeiten | Quelltext bearbeiten]Erscheinungsbild
[Bearbeiten | Quelltext bearbeiten]
Warane entsprechen in ihrem Äußeren der Grundform einer Echse mit vier Beinen und einem Schwanz. Der Kopf ist meist mäßig hoch, vergleichsweise lang und läuft zur Schnauze hin spitz zu; es gibt jedoch eine Reihe von Arten mit hohem Schädel oder auch kurzem Kopf und stumpfer Schnauze. Warane haben wie Schlangen eine lange gespaltene Zunge, die das Doppelte der Kopflänge erreichen kann. Das Auge hat eine runde Pupille. Die Nasenlöcher sind rund oder schlitzförmig und können direkt an der Schnauzenspitze, direkt vor dem Auge oder dazwischen liegen. Lage und Form des Nasenlochs können zur Unterscheidung einzelner Arten herangezogen werden. Der Kopf ist gut vom recht langen Hals abgesetzt. Die Gliedmaßen sind vergleichsweise lang und tragen immer 5 Finger. Die Hintergliedmaßen sind länger als die Vordergliedmaßen. Der Schwanz ist bei den meisten Arten im Querschnitt rund, bei teils wasserbewohnenden (semiaquatischen) Arten ist der Schwanz jedoch als Ruderschwanz seitlich zusammengedrückt. So erzeugt er beim seitlichen Schlagen mehr Antrieb im Wasser. Die Vertreter der V. prasinus-Gruppe hingegen haben lange dünne Greifschwänze, die sie als Kletterhilfe einsetzen. Die Schwanzlänge übertrifft meistens die Kopf-Rumpf-Länge. Warane sehen den nicht näher verwandten Schienenechsen (Teiidae) ähnlich.[8]
Die Färbung von Waranen ist höchst variabel und reicht vom leuchtend grünen Smaragdwaran (V. prasinus) bis hin zum vollkommen schwarzen (melanistischen) Panay-Waran (V. mabitang). Oft kommen Punktmuster oder Querbänderungen vor, und die Grundfarbe stellt im jeweiligen Lebensraum meist eine Tarnfarbe dar. Längsstreifen sind bei Waranen selten. Die Bauchseite ist in den meisten Fällen heller als die Körperoberseite. Jungtiere sind bei einigen Arten deutlich heller oder bunter als Alttiere.[8][4]
Größe und Gewicht
[Bearbeiten | Quelltext bearbeiten]Warane sind bekannt für ihre große Spannweite an Körpergröße und Gewicht: Innerhalb keiner anderen Gattung der Wirbeltiere ist der Unterschied zwischen kleinen und großen Arten größer.[15] Der kleinste Waran ist der Kurzschwanzwaran (V. brevicauda), der eine maximale Gesamtlänge von 23 cm und ein Höchstgewicht von 17 g erreichen kann.[16] Der größte heute lebende Waran ist der Komodowaran (V. komodoensis), der eine Höchstlänge von bis zu rund 3 m bei einem Gewicht von über 70 kg erreichen kann.[17] Der Komodowaran ist die größte heute lebende Echse überhaupt; auch andere mittelgroße bis große Warane gehören zu den größten heute lebenden Echsen.[15] Innerhalb der Warane entwickelten sich mehrmals voneinander unabhängig besonders große bzw. kleine Arten.[15][18][19]
Männchen werden bei den meisten Arten etwas größer als die Weibchen, da die Wachstumsrate der Weibchen im Laufe der Individualentwicklung (Ontogenese) schneller abnimmt als bei Männchen.[20] Außerdem haben Männchen manchmal leicht abweichende Proportionen des Kopfes und der Gliedmaßen, doch ohne eingehendere Untersuchung ist eine sichere Geschlechtsbestimmung bei den meisten Arten nicht möglich.[21]
Beschuppung
[Bearbeiten | Quelltext bearbeiten]
Warane haben größtenteils kleine, einfach gebaute Schuppen. Der Kopf trägt kleine, polygonale Schuppen. Der Schnauzenschild (Rostrale) ist nur undeutlich ausgebildet. Das gilt auch für die nicht sehr deutlich ausgeprägten Nasenschilde (Nasalia); stattdessen sind die Nasenlöcher von vielen kleinen Schuppen umgeben. Bei einigen Arten sind innerhalb der Überaugenschild-Reihen (Supraocularia) auffallend vergrößerte Schuppen ausgebildet. Auch die Nackenschuppen erfuhren bei einigen Arten eine Vergrößerung oder Zuspitzung; als Beispiele seien V. nuchalis und der Raunackenwaran (V. rudicollis) genannt. Die Schuppen des Rumpfes sind länglich oval und in recht regelmäßigen Querreihen angeordnet. Am Schwanz haben viele Zwergwarane der Untergattung Odatria stachelige Schuppen. Bei seitlich zusammengedrückten Schwänzen bilden meist die beiden obersten Schuppenreihen des Schwanzes Kiele aus.[8] Einige Warane (z. B. Grays Waran, V. olivaceus) haben auch besonders gekielte Schuppen auf der Körperunterseite, um beim Klettern zusätzlichen Halt zu haben.[22]
Anatomie
[Bearbeiten | Quelltext bearbeiten]Schädel
[Bearbeiten | Quelltext bearbeiten]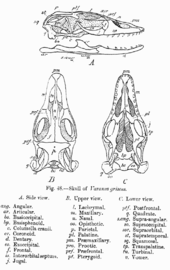
Auffallend am Gesichtsschädel sind die großen, relativ weit hinten liegenden Nasenfenster. Der Oberkieferknochen (Maxillare) ist recht lang. Im Unterkiefer findet sich zwischen dem Unterkieferknochen (Dentale) und einigen angrenzenden Knochen (Coronoid, Supraangulare und Angulare) eine breite, mit Bindegewebe gefüllte Naht. Der Hirnschädel zeigt nur wenige Besonderheiten.[8]
Bedeutend für Warane sind die kinetischen Eigenschaften ihres Schädels, wodurch sie große Beutetiere oder große Stücke dieser ganz verschlucken können. So wird die fehlende Fähigkeit zum Kauen kompensiert.[8] Es sind Fälle bekannt geworden, in denen Warane Beutetiere von 42 % ihres eigenen Körpergewichts verschlungen haben; derart große Beute stellt jedoch die Ausnahme dar.[23] Einerseits ist der Waranschädel metakinetisch: Die Schädelelemente des Hinterkopfes (Occipitalregion) sind mit dem restlichen Schädel beweglich verbunden, der Rest des Schädels kann also gegen den Hinterkopf bewegt werden. Der Waranschädel ist andererseits auch mesokinetisch, der Oberkiefer kann an einem Knickgelenk hinter den Augenfenstern (Orbitae) gegen den Hirnschädel bewegt werden. Die Bindegewebenaht zwischen einigen Unterkieferknochen macht diese ebenfalls gegeneinander beweglich. Wie bei allen Schuppenkriechtieren zeichnet sich auch der Waranschädel durch Streptostylie aus: Das Quadratum ist gelenkig mit seinen angrenzenden Schädelelementen verbunden, was den Schädel weiter beweglich macht.[8][24]
Zähne
[Bearbeiten | Quelltext bearbeiten]Die Zähne der Warane sind bei den meisten Arten seitlich zusammengedrückt, laufen spitz zu und sind nach hinten gekrümmt. Bei einigen Arten sind die Schneiden gesägt. Ausgefallene Zähne werden erneuert, indem neue Zähne im hinteren Teil des Kiefers gebildet werden und kontinuierlich auf freigewordene Plätze nachrücken (Polyphyodontie). Nach Mertens (1942) besitzt ein vollständiges Warangebiss je nach Art 37 bis 71 Zähne. Die ungerade Zahl ergibt sich aus der Besonderheit, dass sich am Zwischenkieferbein (Prämaxillare) fast immer eine ungerade Zahl von Zähnen befindet. Die Anzahl von Zähnen am Oberkiefer entspricht ungefähr der Zahl im Unterkiefer; meist sind es 1–2 mehr im Unterkiefer, es können jedoch auch gleich viele oder weniger sein. Die Zähne sind subpleurodont befestigt. Im Fall von Waranen heißt das, dass je ein mikroskopisch kleines knöchernes Plättchen die Zähne mit den Kieferknochen verbindet.[25] Kleineren Waranen dienen ihre Zähne vor allem zum Festhalten von Beute, große Warane hingegen nutzen ihre Zähne auch zum Herausschneiden von Stücken aus größerer Beute. Hierzu sind die Zähne durch ihre Sägungen besonders gut geeignet.[26][27]
Eine Reihe von Waranarten entwickelt im Lauf ihrer Individualentwicklung hingegen stumpfe, backsteinartige Zähne. Während die Jungtiere solcher Arten meist spitze Zähne zur Jagd auf Insekten haben, ernähren sich die Alttiere vor allem von Weichtieren (z. B. Schnecken).[8] Bekannt ist dieser ontogenetische Zahnwechsel unter anderem vom Nilwaran (V. niloticus).[28] Ebenso ist dieser Zahnwechsel typisch für den Grays Waran (V. olivaceus), der nach abgeschlossenem Zahnwechsel auch Früchte isst.[22]
Zungenbeinapparat
[Bearbeiten | Quelltext bearbeiten]Der Zungenbeinapparat (die funktionelle Einheit aus Zungenbein und anhängenden Muskeln) der Warane entspricht im Grundmuster dem Zungenbeinapparat der meisten Schuppenkriechtiere. Die einzelnen Elemente sind jedoch gegeneinander sehr beweglich, und die dem Zungenbeinskelett anhängenden Muskeln sind ungewöhnlich gut ausgeprägt. So kann das Zungenbein zusammen mit dem Mundboden in viele verschiedene Richtungen bewegt werden.[29] Der Zungenbeinapparat spielt eine wichtige Rolle beim Schlucken von Beute, bei der Atmung und bei Drohgebärden.[29][30][31]
Postcranialskelett
[Bearbeiten | Quelltext bearbeiten]
Das Postcranialskelett (Skelett exklusive Schädel) ist für Schuppenkriechtiere typisch gebaut. Die Wirbel sind an der Vorderseite konkav (procoel). Die Zentren sind flach gedrückt und somit nicht zylindrisch. Mertens (1942) gibt nach Untersuchung von sechs Exemplaren (vier Arten) folgende Zahlen an: sieben Halswirbel, davon die ein bis zwei hinteren mit kurzen Rippen, 22–23 Rückenwirbel, davon bis auf die letzten ein bis drei alle mit Rippen, zwei rippenlose Sakralwirbel und 101–148 Schwanzwirbel. Warane sind nicht zur Autotomie befähigt, können also nicht wie Eidechsen ihren Schwanz abwerfen.[8]
Der Oberarmknochen (Humerus) ist kurz und gedrungen, die Elle (Ulna) ist länger als die Speiche (Radius). Es sind fünf Zehen vorhanden, die Phalangenformel (Anzahl der Zehengliedknochen pro Vorderzehe) der Vorderbeine ist 2–3–4–5–3. Am Oberschenkelknochen (Femur) ist der Gelenkkopf für das Schienbein (Trochanter tibialis) sehr groß, der Gelenkkopf für das Wadenbein (Trochanter fibularis) sehr klein. Das Wadenbein (Fibula) ist etwas länger als das Schienbein (Tibia). Auch am Hinterfuß finden sich fünf Zehen, die Phalangenformel der Hinterbeine ist 2–3–4–5–4.[8]
Hautverknöcherungen
[Bearbeiten | Quelltext bearbeiten]Einige Arten der Warane besitzen unter ihren Schuppen wurmförmige Osteoderme, speziell an den Beinen, dem Schwanzansatz, am Kopf sowie an Hals und Bauchunterseite.[32][33] Bei alten Exemplaren können die kleinen Osteoderme lokal zu durchgehenden Panzern verwachsen. Man geht davon aus, dass diese Knochengebilde unter anderem bei innerartlichen Konflikten einen gewissen Schutz vor Verletzungen darstellen.[34][33] Eine weitere Verknöcherung des Integuments ist das Hemibaculum, eine verknöcherte Struktur am Ende der Hemipenes und der Hemiclitoris. Der Nutzen dieser Struktur ist nicht bekannt. Das Hemibaculum stellt eine Autapomorphie der Warane dar.[35]
Stoffwechselorgane und Physiologie
[Bearbeiten | Quelltext bearbeiten]Herz
[Bearbeiten | Quelltext bearbeiten]
 |
 |
Von besonderer Bedeutung für die Warane sind die ungewöhnlich gebauten Organe Herz und Lunge. Das Waranherz liegt recht weit hinten im Körper und beginnt erst nach dem hinteren Ende des Brustbeins (Sternum). Wie bei allen Schuppenkriechtieren besteht das Waranherz aus zwei Vorhöfen und drei nicht vollständig abgetrennten Kammern, nämlich Cavum arteriosum, C. venosum und C. pulmonale. C. arteriosum und C. venosum werden durch eine Scheidewand (Septum) unvollständig getrennt. C. venosum und C. pulmonale hingegen werden durch die Muskelleiste nahezu vollständig getrennt, jedoch bleibt zwischen der Oberseite der Muskelleiste und der Herzwand ein kleiner Spalt frei. Das C. venosum ist relativ klein. Von dem Septum, das die zwei Vorhöfe trennt, gehen die zwei septalen atrioventricularen Klappen aus. Im Waranherz sind speziell die gut ausgebildete Muskelleiste und die gut ausgeprägten Septen und Klappen wichtig.[36]
Während der Füllungsphase (Diastole) fließt sauerstoffarmes Blut aus dem Körperkreislauf vom rechten Vorhof in das C. venosum und von dort durch eine Öffnung zwischen Muskelleiste und Herzwand weiter ins C. pulmonale. Gleichzeitig fließt sauerstoffreiches Blut aus dem Lungenkreislauf mit höherem Druck aus dem linken Vorhof in das C. arteriosum. Dabei wird die linke septale atrioventriculare Klappe[36] gegen das Septum zwischen C. arteriosum und C. venosum gepresst, wodurch eine vorübergehende, recht effiziente funktionelle Trennung zwischen den beiden Kammern entsteht. Am Anfang der Austreibungsphase (Systole) werden die septalen Vorhof-Kammer-Klappen durch den Blutdruckanstieg in den Herzkammern wieder geschlossen. So werden die Herzkammern von den Vorhöfen abgegrenzt, welche sich erneut mit Blut füllen. Gleichzeitig wird der kleine Spalt zwischen Muskelleiste und Innenwand der Kammer geschlossen. Bei zunehmender Kammerkompression wird das sauerstoffarme Blut des C. pulmonale in den Lungenkreislauf gedrückt. Gleichzeitig wird das sauerstoffreiche Blut des C. arteriosum durch das zuvor noch dem sauerstoffarmen Blut dienlichen C. venosum in den Körperkreislauf gepresst. Praktisch kommt dem C. venosum also nur die Rolle eines Kanals für Blut zu, nicht die Funktion einer autonomen Herzkammer. Während das sauerstoffarme Blut des C. pulmonale praktisch ohne Vermischung zum Lungenkreislauf gepumpt wird, mischt sich das sauerstoffreiche Blut des C. arteriosum mit sauerstoffarmem Blut des C. venosum, welches nicht in das C. pulmonale gelangte.[36][37] Die fortgeschrittene Trennung von sauerstoffarmem und sauerstoffreichem Blut im Herzen ermöglicht eine effektivere Verteilung des Sauerstoffs. Nur etwa 30 % sauerstoffarmes, für den Lungenkreislauf bestimmtes Blut gelangt erneut in den Körperkreislauf, und nur etwa 10 % von sauerstoffreichem Blut aus den Lungen gelangt erneut in den Lungenkreislauf.[38]
Lunge
[Bearbeiten | Quelltext bearbeiten]Die Lungen der Warane sind recht groß. Sie beginnen in beträchtlicher Entfernung hinter dem Herzen und erstrecken sich bis zum vorderen Ende der Leber. Die Bronchien spalten sich in der Lunge in je zwei Äste. Von diesen gehen wiederum kleine Seitenzweige aus, welche in geräumige alveolöse (lungenbläschenreiche) Kammern münden. Dieser mehrkammerige Bau ist eine Autapomorphie der Warane; andere Schuppenkriechtiere haben einfache, sackartige Lungen. Somit gibt es in den Lungen von Waranen eine größere Fläche für den Gasaustausch, welcher daher bei Waranen auch besonders effizient ist.[8][39][35]
Ventilation
[Bearbeiten | Quelltext bearbeiten]Auch die Ventilation der Lungen ist bei Waranen verschieden zu anderen Schuppenkriechtieren. Die meisten Reptilien atmen vorwiegend mithilfe der Zwischenrippenmuskulatur (Musculi intercostales). Diese Muskeln können zu beiden Seiten des Rumpfes die Rippen leicht drehen, den Brustkorb dadurch erweitern und so durch Volumenzunahme die Füllung der Lungen bewirken. Allerdings spielen bei der Fortbewegung von Echsen seitliche Wellenbewegungen des Rumpfes eine wichtige Rolle. Bei mittleren und hohen Geschwindigkeiten wird die Zwischenrippenmuskulatur einseitig zur Biegung des Rumpfes stark angespannt. Dadurch tragen die Musculi intercostales zur Fortbewegung bei, gleichzeitig wird jedoch bei erhöhter Geschwindigkeit die Atmung behindert, obwohl gerade dann eine erhöhte Sauerstoffzufuhr wichtig wäre. Dies bezeichnet man als axial constraint („axiale Beschränkung“). Warane sind in der Lage, mithilfe des Zungenbeinapparats durch gular pumping („Kehlpumpen“) die axiale Beschränkung zu kompensieren. Bei mittleren bis hohen Geschwindigkeiten wird zuerst ein normaler Atemzug getan, der die Lunge nicht vollständig füllen kann. Dann wird der Zungenbeinapparat gesenkt und somit der Kehlraum erweitert und Luft eingesogen. Dann wird der Kehlraum durch den Zungenbeinapparat wieder zusammengepresst und Luft in die Lunge gepumpt. Im Schnitt wird je normalem Atemzug dreimal gepumpt.[30][40] Diese Form der Atmung kommt auch bei anderen Schuppenkriechtieren vor, ist aber bei den Waranen besonders stark ausgeprägt.[41][42]
Aerobe Kapazität
[Bearbeiten | Quelltext bearbeiten]
Aus diesen Anpassungen resultiert eine besonders hohe Fähigkeit zur Aufnahme von Sauerstoff. Die meisten Schuppenkriechtiere haben eine nur geringe aerobe Stoffwechselkapazität und somit eine niedrige anaerobe Schwelle. Für kurze, intensive körperliche Belastungen haben Schuppenkriechtiere die gut ausgeprägte Fähigkeit zur anaerobischen Energiebereitstellung. Schuppenkriechtiere ermüden jedoch schnell, und der pH-Wert des Blutes sinkt durch Milchsäureproduktion (Abfallprodukt des anaeroben Stoffwechsels). Bei Überbelastung entsteht eine metabolische Azidose.[43] Warane hingegen sind für ihre großen aeroben Kapazitäten bekannt. Neben besonderen Anpassungen der Ventilation,[30] der Lungen[44] und des Herzens[36] sind Herz- und Skelettmuskulatur zudem mit einem hohen Gehalt von Myoglobin ausgestattet, wodurch zusätzlicher Sauerstoff gespeichert werden kann.[38] Auch der Hämatokrit der Warane ist höher als bei anderen Echsen.[45] Diese Anpassungen ermöglichen besonders hohe körperliche Leistungen und eine für Schuppenkriechtiere höchst aktive Lebensweise. Neben ihrer größeren Ausdauer verbrauchen Warane im Ruhezustand jedoch nicht mehr Energie als andere Echsen und Schlangen.[46]
Bestätigt wurde dies bei Experimenten, in denen der Leistungsstoffwechsel von Steppenwaranen (V. exanthematicus) und Grünen Leguanen (Iguana iguana) bei 35 °C während 20–45 Minuten Beanspruchung auf einem Laufband verglichen wurde. Der maximale Sauerstoffverbrauch beim Steppenwaran beträgt 1,26 Milliliter pro Gramm Körpergewicht des Tieres pro Stunde. Damit ist er in der Lage, über den Versuchszeitraum eine beständige Laufgeschwindigkeit von 1,2 km/h vollständig aerob zu bestreiten. Für den Grünen Leguan hingegen wurde ein maximaler Sauerstoffverbrauch von 0,82 Milliliter pro Gramm Körpergewicht des Tieres pro Stunde errechnet, damit konnte er auf dem Laufband nur 0,5 km/h vollkommen aerob aufrechterhalten.[45]
Besonders stark ans Wasser gebundene und regelmäßig tauchende Arten der Warane zeigen weitere Anpassungen hinsichtlich der Atmung. Das Blut solcher Arten hat einen besonders hohen Gehalt an Blutpuffern, wodurch der Körper über längere Zeit anaerob Energie gewinnen kann. Zusätzlich kann beim Tauchen die Herzfrequenz um bis zu 85 % gesenkt werden.[47]
Stoffwechselrate, Wasser und Fettkörper
[Bearbeiten | Quelltext bearbeiten]Die Stoffwechselrate von freilebenden Waranen wurde mehrfach untersucht; die Werte reichten von 2,3 kJ/d bei einem 10,4 g schweren V. caudolineatus bis hin zu 1330 kJ/d bei einem 16,62 kg schweren Komodowaran (V. komodoensis). Dazwischen lag z. B. ein 3,28 kg schwerer Arguswaran (V. panoptes) mit 468 kJ/d. Bei Waranen in stark saisonalen Gebieten ist der Stoffwechselumsatz ebenso starken Schwankungen unterworfen, da dann die meisten Arten eine Ruheperiode halten. In der Trockenzeit lag die Stoffwechselrate des untersuchten Arguswarans bei nur 168 kJ/d. Ähnlich verhält es sich mit dem Wasserhaushalt: In der Regenzeit schied der Arguswaran 135 ml/d aus, in der Trockenzeit 58,5 ml/d.[48] Speziell Warane aus Trockengebieten scheiden nur wenig Wasser mit dem Urin aus. Ihren Wasserbedarf decken Warane fast ausschließlich aus dem Wassergehalt ihrer Beutetiere.[49]
Um beutearme Hungerperioden zu überdauern, legen Warane Fettkörper an. Ein Fettkörper findet sich am Schwanzansatz, zwei weitere sind sich gegenüberliegende, lappenartige Gebilde an der Körperunterseite zwischen Bauchfell und Bauchwand.[8] Warane zehren vor allem während der nahrungsarmen Trockenzeit von diesem Fett; Weißkehlwarane (V. albigularis) etwa verlieren über die Trockenzeit bis zu 50 % ihres Körpergewichts.[50] Bei vielen Waranen zehren die Weibchen von ihren Fettkörpern, um Dotter für ihre Eier zu bilden.[4]
Sinnesorgane und Sinnesleistungen
[Bearbeiten | Quelltext bearbeiten]Zunge und Jacobson-Organ
[Bearbeiten | Quelltext bearbeiten]
Die lange, gespaltene Zunge der Warane spielt eine wichtige Rolle bei der olfaktorischen Wahrnehmung. Die Zunge wird im Rahmen des Züngelns zur olfaktorischen Wahrnehmung wiederholt eingezogen und ausgestreckt. Dabei werden an der Zungenspitze Geruchspartikel aus der Luft oder von Oberflächen aufgenommen. Anschließend werden die Geruchspartikel an der Zungenspitze zum Jacobson-Organ am Gaumendach transportiert. Das Jacobson-Organ spielt vor allem bei der Ortung von Beute auf größere Distanzen und beim Sozialverhalten eine Rolle und ist bei Waranen leistungsfähig genug, um vergrabene Beute aufzuspüren.[49] Die Zunge wird von verschiedenen Muskeln bewegt: Einerseits vom M. genioglossus, der an der Unterseite der Zunge und am Unterkiefer ansetzt, sowie durch Muskeln, die vom Inneren der Zunge ausgehen. Diese setzen größtenteils am Zungenbeinskelett an. Die Zunge wird in eine Scheide am Mundboden eingezogen, in welche sie nahezu vollständig passt.[29]
Auge
[Bearbeiten | Quelltext bearbeiten]Die Augen der Warane sind für Reptilien sehr gut entwickelt. Warane haben ein oberes Augenlid, ein unteres Augenlid und eine Nickhaut, die über das ganze Auge gezogen werden kann. In seinem Feinbau ähnelt das Auge der Warane stark dem Auge anderer tagaktiver Reptilien. Die Netzhaut der Warane enthält größtenteils oder ausschließlich Zapfen, somit sind Warane zum Farbsehen befähigt. Jeder Zapfen enthält zwei Öltröpfchen – diese ungewöhnliche Eigenschaft ist wohl eine Eigenart der Warane. Da Warane tagaktiv sind und oft Lebensräume mit hoher Lichtintensität (z. B. Wüsten) bewohnen, sind diese Öltröpfchen wahrscheinlich eine Art Sonnenschutz vor schädlicher kurzwelliger Strahlung.[51]
Warane nehmen besonders Bewegungen gut wahr und erkennen zum Beispiel einen sich bewegenden Menschen aus rund 200 m Entfernung. Stationäre Objekte werden nur unscharf gesehen. Das Gesichtsfeld beläuft sich auf etwa 240°, davon 25° stereoskopisch. Der Sehsinn spielt in der Feindvermeidung, bei der Jagd auf geringe Distanz und im Sozialverhalten eine Rolle.[49] Sprackland (1999) vermutet sogar, dass sich nahe verwandte Waranarten (z. B. in der V. indicus-Gruppe) an den Farben ihrer Zunge unterscheiden können.[52]
Weitere Sinnesorgane
[Bearbeiten | Quelltext bearbeiten]Das Parietalorgan (Scheitelauge) der Warane ist gut entwickelt; äußerlich erscheint es als heller Fleck auf einer vergrößerten Schuppe, dem sogenannten Interparietale.[8] Das Parietalorgan spielt eine zentrale Rolle bei der Thermoregulation (durch Sonnen) und dem Tagesrhythmus; wenn das Parietalorgan experimentell verdeckt wird, so schlafen die Warane oft außerhalb von Verstecken, sind wenig aktiv, sind teils auch in der Nacht aktiv und zeigen kein thermoregulatorisches Verhalten mehr.[53]
Das Gehör der Warane ist nur wenig leistungsfähig; viele Individuen reagieren auch auf laute Geräusche (z. B. Gewehrschuss[8]) nicht.[49]
Gift
[Bearbeiten | Quelltext bearbeiten]
Neuere Studien lassen vermuten, dass alle Warane giftig sind. Fry et al. (2006) erstellten cDNA-Bibliotheken von serösem Gewebe im Unterkiefer von vier Waranarten und untersuchten mittels Massenspektrometrie auch die Mundhöhlensekretionen dieser Arten. In den DNA-Bibliotheken von allen Arten fanden sich Gene, die für Reptiliengifte typische toxische Proteine codieren. Die Massenspektrometrie zeigte, dass sich im Speichel von Waranen eine ganze Reihe toxischer Proteine befinden, die auch in den DNA-Bibliotheken codiert sind. Die toxischen Proteine werden somit aller Wahrscheinlichkeit nach von Giftdrüsen im Unterkiefer produziert. Das Vorhandensein von Giftdrüsen würden die Warane mit allen Mitgliedern des Taxons Toxicofera teilen.[54] Eine weitere Studie von Fry et al. (2010) wies Giftproduktion bei elf weiteren Arten nach; mit großer Sicherheit besitzen also alle Warane Giftdrüsen.[55] Von den grundlegenden Toxicofera-Proteinen enthält das Warangift Proteine der AVIT-Familie, Natriuretische Peptide (B-Typ), CRISP-Proteine, Cobra Venom Factor, Kallikrein und Nerve Growth Factor. Crotamin, Cystatin und Vespryn gingen sekundär verloren, hinzu kam jedoch Phospholipase A2 (PLA2).[56]
Mithilfe von Magnetresonanztomographie (MRT) konnten erstmals beim Komodowaran (V.komodoensis) (Fry et al. 2009) Giftdrüsen nachgewiesen werden; später wurden bei insgesamt 15 Arten (Fry et al. 2010) gleich gebaute Giftdrüsen gefunden. Warane besitzen zu jeder Seite des Unterkiefers eine längliche Giftdrüse, die sich unter den Zahnreihen erstreckt. Diese Drüsen sind jeweils von Bindegewebe eingehüllt und in ein großes hinteres und fünf kleinere vordere Kompartimente unterteilt. Von jedem Kompartiment führt ein separater Gang nach oben, der sich zwischen je zwei Zähnen in die Mundhöhle öffnet. Warane besitzen keine gefurchten oder hohlen Zähne zur Giftübertragung, daher mischt sich das Gift mit anderen Sekreten der Mundhöhle.[57][55]
Die Wirkung und der Nutzen von Warangift sind nur unzureichend erforscht. Das Gift des Komodowarans ist allerdings recht gut untersucht: es verursacht primär einen Volumenmangelschock, hemmt die Blutgerinnung und unterstützt somit den Beutefang (siehe auch Rolle von Gift und Bakterien im Jagdverhalten beim Komodowaran).[57] Bei anderen Arten herrscht noch Unklarheit. Werden die Mundhöhlensekrete eines Buntwarans (V. varius) in eine anästhesierte Ratte injiziert, so führt dies zur Entspannung der glatten Muskulatur der Aorta, wodurch sich Blutgefäße stark erweitern. Ebenso mindert das in dem Gemisch enthaltene Gift die Blutgerinnung (Koagulopathie). Bei einer nicht anästhesierten Ratte würden diese Effekte zu einem starken Abfall des Blutdrucks und Bewusstlosigkeit durch Volumenmangelschock führen.[54] Ein Nutzen beim Beutefang ist bei den meisten Waranen jedoch sehr unwahrscheinlich, da Warane ihre kleine bis mittelgroße Beute üblicherweise lebend verschlucken oder durch rein mechanische Kraft töten. Nach Arbuckle (2009) ist es wahrscheinlicher, dass das Gift durch Bestandteile wie PLA2 die Verdauung unterstützt. Die artspezifischen Variationen der Giftwirkung sind unbekannt.[58]
Die Wirkung des Gifts auf Menschen ist nur unzureichend erforscht. In einigen Fällen wurde von Vergiftungserscheinungen nach Bissen von Waranen berichtet. Laut Fry et al. (2006) führten Bisse vom Komodowaran (V. komodensis), Buntwaran (V. varius) und V. scalaris zu starkem Anschwellen der Bissstelle, Schwindel, stechendem Schmerz und Störung der Blutgerinnung. Die Symptome hielten mehrere Stunden an. Vom Wüstenwaran (V. griseus) ist zudem ein Ausnahmefall publiziert, bei dem zusätzlich Herzrasen (Tachykardie), Muskelschwäche und Atemschwierigkeiten auftraten.[54]
Fortbewegung
[Bearbeiten | Quelltext bearbeiten]

Wie alle Echsen laufen Warane vierbeinig mit seitlich abgespreizten Gliedmaßen. Der Rumpf wird beim Laufen abwechselnd seitlich gebogen (Undulation).[59] Die Vorderbeine tragen etwa 40 % des Körpergewichts, die Hinterbeine etwa 60 %.[60] Beim Laufen halten Warane ihren Kopf und Rumpf weit über dem Boden, und nur die hintere Hälfte des Schwanzes und die Füße berühren ihn. Wenn Warane im Sand laufen, entstehen daher typische Spuren mit Fußabdrücken und eine Schleifspur in deren Mitte.[38][61] Der auffallend lange Schwanz und der ungewöhnlich lange Hals der Warane spielen auch bei der Fortbewegung eine Rolle. Der lange Hals erleichtert aufgrund seiner Beweglichkeit den Fang von schneller, wendiger Beute. Der Schwanz bildet dabei eine Art Gegengewicht zum sich schnell bewegenden Hals. Der Schwanz kann zudem zum schnellen Richtungswechsel verlagert werden.[59] Angaben zur Geschwindigkeit von Waranen sind rar: Goulds Warane (V. gouldii) laufen auf größere Distanzen mit durchschnittlich rund 1,6 km/h, die Geschwindigkeit kann von rund 1,1 km/h bis 2,4 km/h reichen.[62] Der Komodowaran (V. komodoensis) bewegt sich mit durchschnittlich 4,8 km/h fort und kann bei kurzen Sprints bis zu 18,5 km/h erreichen.[32]
Viele Warane sind gute Kletterer. Von mehreren Arten ist bekannt, dass sie ihren Schwanz beim Klettern als Greiforgan einsetzen können. Zahlreiche Arten sind geschickte Schwimmer. Schwimmende Warane legen ihre Beine lose an den Rumpf an und erzeugen durch seitliche Wellenbewegungen von Rumpf und Schwanz Vortrieb. Der Kopf wird dabei über Wasser gehalten. Einige Arten tauchen auch regelmäßig und können teils bis zu einer Stunde unter Wasser bleiben. Reguläre Tauchgänge sind deutlich kürzer. Die allermeisten Warane sind sowohl zum Klettern als auch zum Schwimmen fähig, die Ausprägung dieser Fähigkeiten schwankt jedoch von Art zu Art und hängt von der jeweiligen Lebensweise ab. Es gibt sowohl spezialisierte Baumbewohner, Bodenbewohner und stark ans Wasser gebundene Arten als auch Generalisten.[8]
Verhalten
[Bearbeiten | Quelltext bearbeiten]Aktivität, Thermoregulation und Verstecke
[Bearbeiten | Quelltext bearbeiten]
Alle Warane sind tagaktiv. Abends ziehen sich Warane in ihr Versteck zurück und ruhen bis zum nächsten Morgen. Die meisten Warane sonnen sich dann am Morgen ausgiebig. Je nach den klimatischen Bedingungen in ihrem Verbreitungsgebiet verstecken sich Warane um die Mittagszeit vor zu starker Hitze oder sind zu dieser Zeit aufgrund optimaler Temperaturen besonders aktiv. Wie alle Schuppenkriechtiere sind Warane ektotherm und erhöhen ihre Körpertemperatur durch Sonnen, oder sie kühlen sich durch Rückzug in ein Versteck, in den Schatten oder ins Wasser ab. Warane können durch schnelles Heben und Senken des Mundbodens mittels des Zungenbeinapparates auch „hecheln“ und ihre Körpertemperatur senken; dieses Verhalten führt jedoch zu beträchtlichem Wasserverlust und wird nur bei unmittelbarer Gefahr der Überhitzung angewandt. Aktive Warane haben üblicherweise eine Körpertemperatur von 22–38 °C. Die meisten Warane versuchen, durch aktive Thermoregulation eine Vorzugstemperatur um die 36 °C aufrechtzuerhalten. Die Vorzugstemperatur unterscheidet sich jedoch von Art zu Art und insbesondere semiaquatische Arten bevorzugen niedrigere Körpertemperaturen.[49][38] Einige Arten sind wenig umsichtige Thermoregulatoren und erhalten dennoch eine günstige Körpertemperatur aufrecht. Dies hängt offenbar mit einer größeren Lichtabsorption ihrer Haut zusammen.[63][64]
Warane nutzen viele verschiedene Arten von Verstecken, so etwa Baumhöhlen, dichte Vegetation, Felsspalten und Termitenhügel. Die Mehrheit der Arten hingehen gräbt sich selber einen Bau oder übernimmt den Bau eines anderen Tieres. Einen eigenen Bau legen Warane bevorzugt unter Felsen oder Wurzelwerk an. Bei einigen Arten können selbst gegrabene Baue mehrere Meter lang sein.[49]
Waranarten aus den nördlichen und südlichen Verbreitungsgebieten halten meist eine Ruheperiode. Insbesondere Arten aus Nord- und Südafrika, Australien und Zentralasien bleiben während der Trockenzeit in ihrem Lebensraum weitgehend inaktiv, da zu dieser Zeit Nahrungsmangel herrscht. Zu Beginn der Trockenzeit ziehen sich die Warane in ein Versteck zurück und harren bis zur Regenzeit aus. Arten aus tropischen Gebieten hingegen sind oft das ganze Jahr über aktiv.[65][49]
Aktionsräume, Bewegungen und Sozialverhalten
[Bearbeiten | Quelltext bearbeiten]

Die meisten individuellen Warane bewegen sich in einem angestammten Gebiet, das als Aktionsraum bezeichnet werden kann. Die Aktionsräume von Männchen sind meist deutlich größer als die Aktionsräume von Weibchen. Die Größe von solchen Aktionsräumen hängt auch sehr stark vom Lebensraum und der Waranart ab. Die Aktionsräume von Individuen überlappen sich bei den meisten Arten, und das Streifgebiet wird üblicherweise nicht verteidigt.[49][38] In nahrungsreichen Gebieten können die Aktionsräume kleiner sein, in nahrungsarmen Gebieten hingegen müssen größere Gebiete genutzt werden.[66]
Die täglich von Waranen zurückgelegten Strecken sind je nach Art und Umgebung höchst variabel: Der maximal 80 cm[67] lang werdende V. glauerti etwa legt täglich im Mittel 37 m zurück,[38] der bis zu 1,5 m[49] lange Weißkehlwaran (V. albigularis) hingegen bis zu 5 km.[50] Mit ihrer höheren aerobischen Kapazität sind Warane weit aktiver als andere Echsen und ihre Aktionsräume sind im Vergleich zu ähnlich großen Echsen besonders groß.[46]
Alle Warane sind Einzelgänger und die Individuen eines Gebietes begegnen sich nur selten. Vom Komodowaran (V. komodoensis) ist auch bekannt, dass sie Konfrontationen mit dominanten Individuen aktiv vermeiden.[32] Wenn sich Warane dennoch treffen, so kommt es oft zu Konflikten, da nicht selten beide Warane von ein und derselben Ressource angezogen werden, beispielsweise Aas, Versteckplätze oder Fortpflanzungspartner.[4] Diese Konflikte werden üblicherweise mit einem Kommentkampf gelöst. Solche Kämpfe können in allen Geschlechterkonstellationen auftreten und der Ablauf ist von Art zu Art verschieden.[49][4] Anfänglich werden meist Drohgebärden ausgetauscht: Die Warane beginnen intensiv zu züngeln, nicken mit dem Kopf[68] und blähen mithilfe des Zungenbeinapparats ihre Kehle auf.[31] Die Rivalen beginnen laut zu hissen (zischen, fauchen) und richten sich teilweise auch leicht auf die Hinterbeine auf.[38][68] Lässt sich keiner der Rivalen einschüchtern, so beginnt die clinch-Phase, die von wenigen Sekunden bis zu einer Stunde dauern kann. Beide Kontrahenten richten sich auf ihren Hinterbeinen auf, legen ihre Vorderbeine um den Schulterbereich des Rivalen und versuchen, sich gegenseitig niederzuringen. Schließlich wird ein Waran niedergerungen und der Sieger besteigt das unterlegene Exemplar (Pseudokopulation).[68] Solch ein Kampf legt ein kurzzeitiges Dominanzverhältnis fest und der Sieger kann die umkämpfte Ressource nutzen.[49] Die Kommentkämpfe folgen zwar meist dem hier dargestellten Grundmuster, können sich aber von Art zu Art unterscheiden. Anders als bei Beschädigungskämpfen kommt beim Kommentkampf keiner der Rivalen zu bleibendem körperlichem Schaden, da im Kommentkampf nicht gebissen wird. Beschädigungskämpfe können bei Waranen auch vorkommen, sind aber weit seltener.[49][68] Nicht alle Warane binden eine clinch-Phase in den Kampf ein, auch wenn dieses Verhalten bei Waranen ursprünglich ist. Die clinch-Phase ging in der Indo-Asien B-Gruppe (siehe Biogeographische Entwicklung der heutigen Gruppen) sekundär verloren. Dasselbe ist bei den Zwergwaranen der Untergattung Odatria der Fall; diese führen einen Ringkampf am Boden aus.[69]
Intelligenz
[Bearbeiten | Quelltext bearbeiten]Warane gelten als vergleichsweise intelligent und werden oft als intelligenteste Echsen überhaupt bezeichnet.[3] Zum Beispiel können Warane zählen. Dies wurde mit einem Experiment bewiesen, bei dem Weißkehlwarane (V. albigularis) daran gewöhnt wurden, in einem bestimmten Raum stets eine gegebene Anzahl von Schnecken vorzufinden. Wurde nach mehreren Malen eine Schnecke entfernt, so begannen die Warane nach Verzehr aller vorhandenen Schnecken den ganzen Raum nach der fehlenden Schnecke abzusuchen. Auch die Möglichkeit, in eine weitere Kammer mit Schnecken zu gelangen, wurde nicht genutzt. Erst die Gabe einer weiteren Schnecke beruhigte die Warane. Bei bis zu 6 Schnecken bemerkten die Warane eine fehlende Schnecke. Bei einem anderen Experiment wurden Goulds Waran (V. gouldii), Papuawaran (V. salvadorii) und Buntwaran (V. varius) für intelligent befunden. Man warf einem Waran eine Maus vor, welche dieser sogleich tötete. Dann wurde dem Waran eine weitere Maus gegeben: er unterbrach den Schluckvorgang und tötete die neue Maus. Dies konnte mehrmals wiederholt werden und am Ende fraßen die Warane alle getöteten Mäuse. Ebenfalls können Warane in Gefangenschaft sehr zahm werden und ihre Pfleger von anderen Personen visuell unterscheiden.[70] Es existieren auch Berichte über Nilwarane (V. niloticus), die bei der Jagd kooperierten.[71] Krebs (2007) schließt aus seinen Beobachtungen und der vorliegenden Literatur, dass Warane Probleme lösen können, aus Erfahrungen lernen und ein gutes Gedächtnis haben. Ebenso spricht er Waranen die Fähigkeit zur Generalisation, Kategorisierung und Unterscheidung ähnlicher Individuen zu.[70]
Ernährung
[Bearbeiten | Quelltext bearbeiten]
Nahrungsspektrum
[Bearbeiten | Quelltext bearbeiten]Die meisten Warane sind Fleischfresser und jagen eine große Vielfalt von Beutetieren, sowohl Wirbellose als auch Wirbeltiere. Zu den typischen Beuteobjekten gehören verschiedenste Gliederfüßer (vor allem Insekten und Spinnen), Weichtiere (z. B. Schnecken), Krebstiere, Fische, Amphibien (v. a. Frösche), Reptilien, Vögel (v. a. Jungvögel) und kleine Säuger. Daneben werden auch die Eier von Reptilien und Vögeln erbeutet, und eine Reihe von Waranen frisst auch Aas.[72][58]
Das Nahrungsspektrum eines individuellen Warans hängt stark von seiner Größe, seiner Umwelt und der Jahreszeit ab. Kleine Arten und Jungtiere großer Arten ernähren sich fast ausschließlich von kleinen Wirbellosen, und auch bei großen Arten machen Wirbellose üblicherweise den mengenmäßigen Großteil der Beute aus. Daneben jagen größere Warane auch kleine bis mittelgroße Wirbeltiere; diese sind dann energetisch wohl oft ebenso wichtig wie die Wirbellosen.[72] Alle Warane jagen Beute, die kleiner ist als sie selbst, auch wenn Beutetiere durchaus um die 20 % des eigenen Körpergewichts ausmachen können.[65] Nur der Komodowaran (V. komodoensis) jagt große Säugetiere wie beispielsweise Hirsche oder Wasserbüffel.[72][49]
Eine Ausnahme unter den größtenteils fleischfressenden Waranen bildet die Untergattung Philippinosaurus mit den 3 Arten Grays Waran (V. olivaceus), Panay-Waran (V. mabitang) und V. bitatawa. Diese Arten fressen neben einem gewissen Anteil an kleinen Wirbellosen fast ausschließlich Früchte, bevorzugt von Schraubenbäumen (Pandanus).[73][74][13] Die drei Arten von Philippinosaurus entwickelten einen ausgeprägten Blinddarm. Er enthält symbiontische Bakterien und erleichtert den Aufschluss der Pflanzennahrung.[22][74] Bei allen anderen Waranen fehlt der Blinddarm oder ist nur rudimentär ausgeprägt.[8]
Beuteerwerb
[Bearbeiten | Quelltext bearbeiten]Die meisten Arten der Warane suchen züngelnd große Gebiete nach Nahrung ab. Mit ihrer durch hohe Sauerstoffkapazität bedingten großen Ausdauer verwenden sie einen verhältnismäßig großen Teil ihrer Zeit zur Nahrungssuche.[46] Während ihrer Suche verbringen sie wiederum viel Zeit damit, erfolgversprechende Orte wie Wurzelwerk, Laubhaufen, Baue oder hohle Baumstämme zu untersuchen.[72] In Laub o. ä. versteckte Beute wird mit der Schnauze oder den Vordergliedmaßen hervorgewühlt. In der Nähe verlassen sich Warane bei der Jagd auf den Sehsinn: Sobald sich die Beute bewegt, wird sie in einer schnellen Vorwärtsbewegung gepackt. Kleine Beutetiere werden lebendig verschluckt, große Beutetiere werden totgeschüttelt oder gegen harte Gegenstände geschlagen.[49] Etliche Warane jagen auch in Bäumen.[72] Teils wasserbewohnende Arten hingegen suchen u. a. auf dem Gewässerboden laufend und züngelnd nach Beute.[75] Wieder andere Arten schwimmen bei der Jagd frei im Wasser und verfolgen teilweise auch aktiv schwimmend Fische.[76][77] Ebenso können semiaquatische Warane durch heftige Seitwärtsbewegungen ihres Schwanzes Fische an Land[78] oder in seichtes Wasser befördern, wo sie leicht zu fangen sind.[71] Mit ihrem Geruchssinn spüren Warane vergrabene Reptiliennester auf, die sie ausgraben.[63] Nur wenige Warane scheinen Lauerjäger zu sein; über deren Jagdverhalten ist jedoch nur wenig bekannt.[72] Das Jagdverhalten von Waranen korreliert mit ihrer artspezifischen Stoffwechselrate und aerobischen Kapazität: Während Arten mit hohen Stoffwechselrate weite Gebiete absuchen, zeichnen sich die Lauerjäger durch recht niedrige aerobische Kapazitäten aus.[46]
Beute wird üblicherweise mit dem Kopf voran und ganz verschluckt. Die dünne Zunge der Warane ist nicht in der Lage, ein im Maul befindliches Beuteobjekt Richtung Speiseröhre zu bewegen. Anfänglich wird unter Ausnutzung der Schwerkraft der Kopf hochgestreckt, um das Beutetier in den geweiteten Schlund zu befördern. Reicht dies nicht aus, so wird das Beutetier mithilfe von Felsen oder der Erdoberfläche als Widerstand weiter in den Rachen gedrückt[49] oder der Waran setzt den Zungenbeinapparat zur weiteren Manipulation der Beute ein.[29] Dabei wird zuerst der Mundboden mithilfe des Zungenbeinapparats gehoben. Anschließend wird der Zungenbeinapparat zurückgezogen und wieder entspannt. Das Beuteobjekt wird auf diese Weise in Richtung Kehlregion und Speiseröhre gezogen. Sobald das Beuteobjekt noch tiefer im Schlund ist, verändert sich das Bewegungsmuster: Der Zungenbeinapparat wird vor das Beuteobjekt bewegt. Dann wird der Zungenbeinapparat angehoben, um die Kehlregion zu komprimieren. Anschließend wird der Zungenbeinapparat nach hinten gezogen und das Beuteobjekt Richtung Speiseröhre geschoben. Größere Beute wird teilweise mit den Vorderbeinen fixiert, um dann mit den Kiefern einzelne Stücke aus ihr herauszureißen.[27] Beim Trinken spielen die Muskeln des Zungenbeinapparats offenbar keine Rolle.[29]
Fortpflanzung und Entwicklung
[Bearbeiten | Quelltext bearbeiten]Paarungsverhalten
[Bearbeiten | Quelltext bearbeiten]
Die Paarung findet üblicherweise nur während eines kurzen Zeitfensters des Jahres statt; Arten aus besonders äquatornahen Gebieten haben jedoch recht ausgedehnte Paarungszeiten.[49] Bei den meisten Arten sondern die Weibchen offenbar Pheromone ab, welche die Männchen anlocken. Diese Duftstoffe werden aller Wahrscheinlichkeit nach in sogenannten Präanaldrüsen produziert, welche vor der Kloake in die Haut eingelagert sind.[79] Von anderen Arten ist wiederum bekannt, dass sich die Geschlechter oft an Aas treffen.[32] Zur Paarungszeit sind die Männchen besonders aktiv und legen ungewöhnlich große Distanzen auf der Suche nach Weibchen zurück. Wenn sie ein Weibchen finden, so umwerben die Männchen der meisten Arten die potenzielle Partnerin durch Bezüngeln, Kratzen und Anstupsen mit der Schnauze. Die Paarung verläuft wie bei den meisten Echsen: Das Männchen besteigt das Weibchen, legt seine Vorderbeine um ihre Schultern und führt von der Seite einen Hemipenis in die Kloake des Weibchens. Bei einigen Arten wehren sich die Weibchen gegen die ersten Paarungsversuche, indem sie nach den Männchen schlagen oder sie beißen; die Männchen dieser Arten fixieren die Weibchen mit ihren Vorderbeinen besonders stark. Auch ist bekannt, dass sich einige Arten nicht unmittelbar paaren, sondern erst 1–2 Tage nach dem Aufeinandertreffen. Treffen sich mehrere Männchen bei einem Weibchen, so kommt es zum Kommentkampf um das Recht zur Paarung.[38]
Gelege, Eiablage, Schlupf und Entwicklung der Jungtiere
[Bearbeiten | Quelltext bearbeiten]Die Trächtigkeit dauert bei den meisten Arten in Gefangenschaft um die 4–6 Wochen.[38] Die Gelege umfassen bei freilebenden Tieren je nach Art im Schnitt 2,5–24,5 Eier. Besonders fruchtbar sind die afrikanischen Arten. Die Eier von Waranen haben eine lederartige Schale und wiegen im Schnitt artabhängig 3,1–131,9 g. Größe und Anzahl der Eier eines Geleges nehmen mit der Größe des Weibchens und dem Nahrungsangebot zu.[80] Das gesamte Gelege kann bei hochträchtigen Weibchen um die 50 % des Körpergewichts ausmachen. Der Zeitpunkt der Eiablage variiert stark von Art zu Art und mit dem Klima in ihrem Verbreitungsgebiet. Meist werden die Eier so gelegt, dass die Jungtiere zum Höhepunkt der Regenzeit schlüpfen; so haben sie nach der Geburt das höchstmögliche Nahrungsangebot.[49] Die Weibchen bodenbewohnender Arten legen ihre Eier meist in selbstgegrabene und anschließend wieder zugeschüttete Nisthöhlen (oft in Böschungen gegraben), baumbewohnende Arten oft in Baumhöhlen.[38][49] Eine ganze Reihe von Arten legt ihre Eier in Termitenhügel, baumbewohnende Warane auch in die Nester von baumbewohnenden Termiten. Dazu wird ein Tunnel in den Hügel gegraben und am Ende eine Kammer zur Eiablage ausgehöhlt. Die Weibchen füllen das Loch nur teilweise auf; die Termiten bauen den Rest wieder zu.[38] In den Termitenbauten sind Luftfeuchtigkeit und Temperatur weit stabiler als außerhalb des Baus,[81] und die Eier sind vor Beutegreifern weitgehend in Sicherheit.[49]
Die durchschnittliche Brutdauer (Inkubationszeit) bei 30 °C beträgt von Art zu Art 91,7–226 Tage (Thompson & Pianka 2001, 33 Arten).[80] In der Natur kommen bei einigen Arten auch Inkubationszeiten von bis zu 300 Tagen vor, die Eier überdauern also die Trockenzeit und die Jungtiere schlüpfen zur nächsten Regenzeit.[22] Die Geschlechtsdetermination erfolgt bei Waranen genetisch: Die Weibchen sind hemizygot mit einem WZ-Paar von Geschlechtschromosomen, die Männchen sind mit ZZ homozygot (ZW/ZZ-System).[82] In Termitenbauten geschlüpfte Jungtiere graben sich bei einigen Arten selber frei,[83] von anderen in Termitenbauten nistenden Arten ist hingegen bekannt, dass die Weibchen die geschlüpften Jungtiere aus dem harten Bau freigraben. Offenbar erinnern sich die Weibchen an ihren Eiablageplatz und kehren regelmäßig dorthin zurück. Genaueres ist über diese mütterliche Fürsorge nicht bekannt. Jungtiere können in einem Termitenhügel 2–3 Wochen überleben, indem sie von ihrem Dotter zehren.[23] Ansonsten zeigen Warane keine Fürsorge für ihre Jungtiere.[49]
Über das Wachstum von Waranen in der Natur liegen kaum Daten vor. In Gefangenschaft erreichen kleine Arten oft nach rund einem Jahr ihre nahezu endgültige Größe und wachsen dann nur noch sehr langsam. Große Arten hingegen wachsen oft noch im Alter von über 5 Jahren. Die Geschlechtsreife tritt je nach Art früher oder später ein, beim Komodowaran (V. komodoensis) zum Beispiel nach 5 Jahren[38] und beim Kurzschwanzwaran (V. brevicauda) teilweise schon nach 10 Monaten.[16]
Parthenogenese
[Bearbeiten | Quelltext bearbeiten]Bisher wurde bei drei Arten der Warane von Parthenogenese berichtet, wahrscheinlich verfügen also alle Arten über diese Fähigkeit. Fälle von Parthenogenese sind sehr selten, und die Berichte stammen ausschließlich von in Gefangenschaft lebenden Weibchen, die keinen Kontakt zu männlichen Tieren hatten.[84][85][86][82] Die Parthenogenese erfolgt bei Waranen automiktisch mit terminaler Fusion, das heißt, dass anfänglich eine ganz normale Meiose stattfindet. Es liegen also haploide Keimzellen vor. Durch besondere Polkörperchen verschmelzen anschließend haploide Keimzellen mit dem gleichen Erbgut wieder zu diploiden Zygoten (also Selbstbefruchtung). In der Konsequenz bestehen alle Chromosomenpaare aus gleichen Chromosomen, auch die Geschlechtschromosomen. Bei Waranen liegt das ZW-System zur Geschlechtsdetermination vor; Weibchen haben das Geschlechtschromosomenpaar ZW, Männchen ZZ. Ein Jungtier mit zwei W-Geschlechtschromosomen stirbt bereits im Ei ab. Daher schlüpfen nur Männchen, diese haben von ihrer Mutter zwei Z-Chromosomen erhalten. Da gewissermaßen nur „eine Hälfte“ des mütterlichen Erbguts ausgeprägt ist, sind zahlreiche Gene homozygot. Die Auswirkungen durch ansonsten rezessive, schädliche Mutationen kann mit 10 bis 15 Generationen Inzucht zwischen Geschwistern verglichen werden. So sterben auch männliche Tiere oft schon im Ei ab und nur in seltenen Fällen sind parthenogenetisch gezeugte Warane lebensfähig. Der Nutzen von Parthenogenese bleibt höchst spekulativ.[82]
Natürliche Feinde, Feindvermeidung und Lebenserwartung
[Bearbeiten | Quelltext bearbeiten]Den meisten Waranen stellen Schlangen, andere Waranarten,[65] Greifvögel und Raubsäuger nach. Wasserlebende Arten werden auch von großen Raubfischen gejagt. Ausgewachsene Exemplare großer Arten haben hingegen nur wenige Feinde.[49] Daneben werden Warane von diversen Ekto- und Endoparasiten befallen; am häufigsten sind Zecken aus den Gattungen Aponomma und Amblyomma sowie Fadenwürmer aus der Gattung Abbreviata.[38][87]
Meistens fliehen Warane vor Feinden in ein Versteck, speziell größere Arten können aber auch aggressiv auf Feinde reagieren. Sie zeigen ein ähnliches Drohverhalten wie gegenüber Artgenossen und zischen laut. Warane wehren sich gegen Feinde durch Bisse und durch Schläge mit ihrem Schwanz.[32][38] Nach einzelnen Berichten können Schwanzschläge von großen Exemplaren die Beine von Hunden brechen.[38] Menschen gegenüber fliehen die allermeisten Arten sofort,[49] und auch der große Komodowaran (V. komodoensis) beißt nur, wenn er in die Enge getrieben wird.[32] Nur von wenigen Waranen ist bekannt, dass sie sich tot stellen.[71]
Daten zur Mortalität und Lebenserwartung sind rar. Speziell junge Warane dürften in der Natur eine außerordentlich hohe Mortalität haben. Daten zur Lebenserwartung sind praktisch nur aus Gefangenschaft bekannt, wo sich Warane als vergleichsweise langlebig erweisen.[49] Für mehrere Arten sind Lebensalter um die 10 Jahre belegt.[38] Der Komodowaran (V. komodoensis) kann wahrscheinlich über 30 Jahre alt werden,[17] und auch Exemplare von kleinen Waranarten wurden in Ausnahmefällen bis zu 20 Jahre in Gefangenschaft gehalten.[49]
Systematik
[Bearbeiten | Quelltext bearbeiten]
Ein Kladogramm der näheren Verwandtschaft der Warane nach Pyron et al., 2013[88]
|
Externe Systematik
[Bearbeiten | Quelltext bearbeiten]Die Gattung der Warane (Varanus) bildet mit einigen ausgestorbenen Gattungen die Familie Varanidae. Der nächste rezente Verwandte ist der Borneo-Taubwaran (Lanthanotus borneensis), der in eine eigenständige, monotypische Familie (Lanthanotidae) eingeordnet wird.[89] Varanidae und Lanthanotidae bilden die Schwestergruppe der Shinisauridae mit nur einer rezenten Art, der Krokodilschwanzechse (Shinisaurus crocodilurus). Die Klade aus diesen drei Familien bildet zusammen mit den Krustenechsen (Helodermatidae), den Höckerechsen (Xenosauridae), Schleichen (Anguidae) und Ringelschleichen (Anniellidae) die Gruppe der Schleichenartigen (Anguimorpha), die zusammen mit den Leguanartigen (Iguania) und den Schlangen (Serpentes) die Gruppe der Toxicofera innerhalb der Schuppenkriechtiere (Squamata) bilden.[88]
Ungelöst ist das Verhältnis der Warane zu den kretazischen Aigialo- und Mosasauriern, auch wenn diese früher oft in die Nähe der Warane gestellt wurden.[90]
Interne Systematik
[Bearbeiten | Quelltext bearbeiten]Als Begründer der Waransystematik gilt der deutsche Herpetologe Robert Mertens (1894–1975). 1942 wurden drei wegweisende Arbeiten von Mertens über Warane in den Abhandlungen der senckenbergischen naturforschenden Gesellschaft veröffentlicht. Mertens’ Systematik gilt heute zwar als überholt, seine Arbeiten ebneten jedoch den Weg für moderne Systematiker.[3]
Aktuell werden innerhalb der Warane etwa 80 rezente Arten als gültig anerkannt.[91][1] Momentan werden diese auf 9 Untergattungen verteilt. Diese Unterteilung wurde mit Untersuchungen der Hemipenismorphologie durch die deutschen Herpetologen Wolfgang Böhme und Thomas Ziegler im Jahr 1997 etabliert, zuvor erschienen bereits einige Arbeiten von Böhme.[92] Sie begründeten die Untergattung Soterosaurus (Ziegler & Böhme, 1997) und verwendeten alte Untergattungen oder definierten diese neu, nämlich Empagusia (Gray, 1838), Euprepiosaurus (Fitzinger, 1843), Odatria (Gray, 1838), Papusaurus (Mertens, 1958), Philippinosaurus (Mertens, 1959), Polydaedalus (Wagler, 1830), Psammosaurus (Mertens, 1942) und Varanus (Merrem, 1820). Innerhalb vom Empagusia wird eine V. bengalensis-Gruppe separiert, in Euprepiosaurus zwischen V. prasinus- und V- indicus-Gruppe unterschieden, Odatria in V.-acanthurus-Gruppe und V.-timorensis-Gruppe aufgeteilt, Polydaedalus setzt sich aus einer V. niloticus-Gruppe und einer V. exanthematicus-Gruppe zusammen und in Varanus wird eine V. gouldii-Gruppe abgesondert.[92][93][91] Diese Einteilung stimmt bis auf wenige Punkte mit später durchgeführten molekularbiologischen Untersuchungen überein. Dennoch hat sich die Unterteilung anhand des Hemipenisbaus etabliert, und die Gattungsnamen werden in molekularbiologischen Untersuchungen wieder aufgegriffen. Da noch nicht alle Warane genetisch untersucht wurden, ist noch keine rein molekularbiologisch begründete Systematik in Verwendung.[94]
Eine komplette Liste aller Arten ist unter Systematik der Warane verfügbar. Die Liste ist nach Untergattungen sortierbar, ebenso können die Waranarten nach Ergebnissen aus der Molekularbiologie angeordnet werden.
Phylogenie
[Bearbeiten | Quelltext bearbeiten]
|
Biogeographische Entwicklung der heutigen Gruppen
[Bearbeiten | Quelltext bearbeiten]Während der Fossilbeleg der Warane recht spärlich ist,[95] so kann anhand molekularbiologischer Studien (z. B. Ast 2001, Fitch et al. 2006, Ziegler et al. 2007, Amer & Kumazawa 2008) und einiger wichtiger Fossilien (Hocknull et al. 2009) die Entwicklungsgeschichte der Warane rekonstruiert werden. Begünstigt wurde die Ausbreitung der Warane wahrscheinlich durch ihre guten Fähigkeiten zur Fortbewegung. Einen großen Einfluss auf die Ausbreitung der Warane hatten sicherlich die sinkenden und steigenden Meeresspiegel während des Pleistozäns. Während der Eiszeiten banden Gletscher große Mengen Meerwasser in sich, und in der Folge sanken die Meeresspiegel um bis zu 100 m. Durch das tendenziell eher flache Meer in der indoaustralischen Inselwelt wurde die Ausbreitung auf den Archipeln begünstigt.[96]
Höchstwahrscheinlich entstanden die Warane in Zentralasien. Ein aus dem Eozän stammendes, etwa 53 Millionen Jahre altes, relativ gut erhaltenes Skelett mit fast vollständigem Schädel wurde in der chinesischen Provinz Hubei gefunden und unter der Bezeichnung Archaeovaranus beschrieben.[97] Auch andere primitive Schleichenartige wurden überwiegend in Zentralasien gefunden.[95] Die zu den Waranen führende Entwicklungslinie spaltete sich laut molekularer Uhr von Amer & Kumazawa (2008) vor etwa 60 Millionen Jahren ab.[98] Die ältesten bekannten Fossilien von der Gattung Varanus sind 37 Millionen Jahre alte Wirbel aus Ägypten.[99] Nach den mtDNA-Analysen von Ast (2001) bilden alle 6[100] afrikanischen Arten die Schwestergruppe zu den übrigen Waranen.[18] Also wanderten basale Varanus wahrscheinlich aus Zentralasien nach Südasien und Afrika.[96][98] Nach Ast (2001) teilen sich die nicht-afrikanischen Warane in 2 große Kladen auf: Den Indo-Asien-Kladus und den Indo-Australien-Kladus. Der Indo-Asien-Kladus teilt sich in 2 große Gruppen auf: Indo-Asien A und Indo-Asien B.[18] Diese beiden Entwicklungslinien trennten sich vor etwa 51 Millionen Jahren.[98] Indo-Asien A enthält einerseits die bereits von Ziegler & Böhme (1997) postulierte Untergattung Empagusia, welche bis auf den Raunackenwaran (V.rudicollis) monophyletisch ist. Dieser ist stattdessen das Schwestertaxon zum sogenannten V.-salvator-Komplex (bei Ziegler & Böhme Soterosaurus), welcher zusammen mit V. rudicollis das Schwestertaxon zu Empagusia excl. V. rudicollis ist. Einerseits entwickelte sich in Südostasien und im Sunda-Archipel also Empagusia, andererseits eine rudicollis-ähnliche Art. Das Ausmaß genetischer Variabilität innerhalb verschiedener V. salvator-Arten und Ast's (2001) Analysen lassen vermuten, dass eine rudicollis-ähnliche Art während einer Periode von global niedrigem Meeresspiegel während des Pleistozäns in die Philippinen einwanderte. Dort entstanden der heutige V. rudicollis sowie V. nuchalis mit ebenfalls rauen Nackenschuppen, während eine V.-cumingi-ähnliche Form der Ursprung für eine Radiation Richtung Süden und Westen war. Aus dieser Radiation gingen zahlreiche Arten des V. salvator-Komplexes hervor (z. B. V. salvator, V. togianus).[12]
In Indo-Asien B fand die erste Aufspaltung vor etwa 34 Millionen Jahren statt.[98] Daraus ging die philippinische Untergattung Philippinosaurus[18][101][13] und die Untergattung Euprepiosaurus hervor. Euprepiosaurus entwickelte sich aller Wahrscheinlichkeit nach auf den Molukken; durch den schlechten Fossilbeleg ist dies jedoch nur eine von mehreren Möglichkeiten. Die Untergattung Euprepiosaurus unterteilt man in die zierlich gebaute, baumbewohnende V.-prasinus-Gruppe und die oft ans Wasser gebundene V.-indicus-Gruppe, welche kräftiger gebaut ist und seitlich zusammengedrückte Schwänze aufweist. Von den Molukken wanderte diese höchst diverse Gruppe nach Neuguinea und auf die Salomonen aus, einzelne Arten auch bis nach Australien. Die genauen Speziationsprozesse bleiben ungeklärt, einzig die Monophylie der beiden Gruppen ist bestätigt. Wahrscheinlich spielte allopatrische Artbildung auf den zahlreichen kleinen Inseln eine entscheidende Rolle und begründete die Vielfalt sowie den hohen Grad an Endemismus.[5]
Der Indo-Australische Kladus erreichte vor etwa 15 Millionen Jahren Australien;[98] als Ausbreitungskorridor kommen die Kleinen Sunda-Inseln in Frage.[96] Anfangs bildeten sich in sehr schneller Speziation drei Gruppen aus: Einerseits die Zwergwarane der Untergattung Odatria, andererseits die zwei Schwestergruppen V. gouldii und V. varius-Gruppe. Der Split zwischen geringer und enormer Körpergröße ist innerhalb der australischen Warane basal. Die Artbildungsrate nahm zwar bis heute wieder ab, erfolgte jedoch nach der Kolonisation sehr schnell. Bis heute leben die meisten Arten der Warane in Australien. Odatria wird in die eher baumbewohnende V. tristis-Gruppe und die bodenbewohnende V. acanthurus-Gruppe gespalten.[19] Die V. gouldii-Gruppe enthält alle typischen großen australischen Warane bis auf den Buntwaran (V. varius). Dieser ist näher mit dem Papuawaran (V. salvadorii) auf Neuguinea und dem Komodowaran (V. komodoensis) verwandt.[19] Diese sehr großwüchsige Gruppe (Buntwaran 2 m, Papua-Waran und Komodowaran > 2,5 m) entwickelte sich in Australien. Während der niedrigen Meeresspiegel während des Pleistozäns wanderten einige Vertreter dieser Gruppe wieder aus Australien aus. Am Fossilbeleg kann die schrittweise Ausbreitung gen Nordwesten über Timor und die kleinen Sunda-Inseln bis nach Java belegt werden. Erst in jüngerer Zeit starben Vertreter der V. varius-Gruppe in großen Teilen ihrer Verbreitung aus, so dass heute nur noch V. varius in Australien und V. salvadorii sowie V. komodoensis außerhalb von Australien bleiben.[102] Einige Warane der V. gouldii-Gruppe erreichten später wieder Neuguinea; dazu gehört z. B. eine Unterart des Arguswarans (V. panoptes horni).[96]
Warane und die Wallace-Linie
[Bearbeiten | Quelltext bearbeiten]
Die Evolution der Warane wurde maßgeblich von der Wallace-Linie beeinflusst. Östlich dieser biogeographischen Grenze existieren keine Raubtiere (Carnivora).[9] Westlich der Wallace-Linie leben vor allem große Waranarten und nur sehr wenige kleine Arten. Östlich der Wallace-Linie hingegen nimmt die Anzahl kleiner Waranarten (z. B. V. prasinus-Gruppe[5] und Odatria) enorm zu, während die Anzahl kleiner Raubsäuger (z. B. Marder) stark abnimmt. Westlich der Wallace-Linie können große Waranarten existieren, da sie viele Jungtiere haben und diese schnell wachsen. Somit sind diese Arten gegen Bejagungsdruck von kleinen bis mittelgroßen Raubsäugern resistent. Kleine Arten sind in jedem Alter diesem Druck ausgesetzt. In Wallacea hingegen konnten sie entstehen und existieren bis heute. Gleichzeitig nehmen sie die ökologische Nische von kleinen Raubsäugern ein.[9]
Fossilbeleg
[Bearbeiten | Quelltext bearbeiten]
Von Waranen liegen als Fossilien meist Wirbel vor, insgesamt ist der Fossilbeleg eher spärlich. Ein relativ gut erhaltenes Skelett mit fast vollständigem Schädel wurde in der chinesischen Provinz Hubei gefunden und unter der Bezeichnung Archaeovaranus beschrieben. Es ist etwa 53 Millionen Jahre alt und stammt somit aus dem frühen Eozän.[97] In Afrika kennt man mit V. rusingensis nur eine benannte fossile Waranart, welche gleichzeitig die älteste mit einem binominalen Namen beschriebene Varanus-Art überhaupt ist. Das kenianische Fossil stammt aus dem frühen Miozän. Auch in Europa lebten Warane, besonders weit verbreitet war der pliozäne V. marathonensis. In Deutschlands und Frankreichs Miozän fand man V. hofmanni.[95] In Europa starben die Warane wahrscheinlich im Zuge einer Klimaabkühlung etwa während der Eiszeiten aus.[96] In Asien und Australien fanden Paläontologen ebenfalls einige Fossilien von ausgestorbenen und heute noch lebenden Arten, insbesondere auch einige sehr große Arten. Der wohl bekannteste fossile Waran ist V. priscus, der im Pleistozän von Australien lebte und eine Länge von etwa 6 m erreichte.[95] Anhand seines Schädelbaus kann V. priscus der V. varius-Gruppe zugeordnet werden.[103]
Bedeutung für den Menschen
[Bearbeiten | Quelltext bearbeiten]
Warane sind bedeutend für den internationalen Lederhandel; Waranleder ist neben der oft attraktiven Musterung auch lange haltbar und wird zu Uhrarmbändern, Schuhen, Geldbeuteln, Handtaschen und anderen Gütern verarbeitet. Daneben ist das Fleisch von Waranen für die lokale Bevölkerung ein wichtiges Nahrungsmittel: bevorzugt gegessen werden Leber und Schwanzansatz sowie die Eier der Tiere. In Asien werden insbesondere Bindenwaran (V. salvator), Gelbwaran (V. flavescens) und Bengalenwaran (V. bengalensis) bejagt, in Afrika vor allem der Nilwaran (V. niloticus), der Steppenwaran (V. exanthematicus) und der Weißkehlwaran (V. albigularis). Wichtige Exporteure in Asien sind Indonesien, die Philippinen, Thailand, Bangladesch, Indien und Pakistan, in Afrika Nigeria, Sudan, Mali und Kamerun. In Australien sind Warane keiner Verfolgung durch den Menschen ausgesetzt. Die Anzahl der getöteten Exemplare pro Jahr geht bei einigen Arten wahrscheinlich in die Millionen.[49][104] Von einigen Arten werden jährlich auch mehrere Tausend Exemplare für den Heimtierhandel gefangen, insbesondere der Steppenwaran (V. exanthematicus) und der Nilwaran (V. niloticus) sind in dieser Hinsicht bedeutend.[105] Gewerbliche Zucht von Waranen wäre gegenüber der Jagd auf freilebende Exemplare sehr unrentabel, daher stammen alle Waranhäute von Wildfängen. Gelegentlich werden auch die Praktiken der Lederindustrie kritisiert; in Südostasien werden Bindenwarane aufgrund unzureichender Tötungsmethoden (Hammerschläge auf den Kopf) oft lebendig gehäutet. Zuvor werden die Tiere tagelang mit zusammengebundenen Beinen gelagert.[106] Daneben stellen eine Reihe von Ethnien aus Waranen traditionelle Medizin her. Warane machen sich als Vertilger von Schädlingen wie Nagern und Insekten nützlich. Andererseits sind sie oft wegen Angriffen auf kleine Haustiere wie Hühner unbeliebt.[49]
Daneben existieren in zahlreichen Ethnien kulturelle Bezüge zu Waranen, sowohl positive als auch negative. Aus Höhlen in der Nähe von Bhopal (Indien) sind 10.000 Jahre alte Zeichnungen von Waranen bekannt.[107] Ein besonders ungewöhnliches Verhältnis zu Waranen haben die Bugis und Makassaren auf Sulawesi: Sie sehen Warane als Zwillinge ihrer Kinder und schreiben ihnen eine menschliche Seele zu. Die Echsen werden in den Familienalltag eingebunden.[108]
Einige Arten der Warane sind beliebt in der Terraristik. Dies ist jedoch auch mit massenhaften Lebendimporten von Wildfängen sowie teils auch unverantwortlicher oder nicht artgerechter Haltung verbunden, etwa wegen falscher Ernährung oder zu kleiner Unterkünfte.[109]
Gefährdung und Schutz
[Bearbeiten | Quelltext bearbeiten]Die Rote Liste gefährdeter Arten der IUCN hat Einträge für 20 Arten von Waranen. Von diesen 20 Arten bezeichnet die IUCN 13 als ungefährdet (least concern), 1 als gering gefährdet (near threatened) und 3 als nicht ausreichend bekannt (data deficient). Als gefährdet (vulnerable) werden der Komodowaran (V. komodoensis) und der Grays Waran (V. olivaceus) geführt, und der Panay-Waran (V. mabitang) wird als stark gefährdet eingestuft.[2] Das Washingtoner Artenschutzabkommen (CITES) legt Handelsbeschränkungen auf alle Waranarten und aus ihnen hergestellte Produkte,[110] diese werden jedoch teilweise nicht beachtet.[2] 5 Arten sind in Anhang I gelistet, alle restlichen Arten in Anhang II.[110]
Eine Reihe von Waranarten ist durch Habitatzerstörung, Habitatfragmentierung und Jagd bedroht,[2] einige besonders stark bejagte Arten scheinen jedoch dem Verfolgungsdruck durch hohe Fortpflanzungsraten standzuhalten und gelten daher auch als nicht gefährdet (z. B. Nilwaran, V. niloticus & Bindenwaran, V. salvator).[104][111] Ebenso sind viele Arten sehr anpassungsfähig und daher durch Habitatzerstörung nur wenig bedroht, während andere starke Bestandseinbußen erleiden.[2] Kleine Waranarten, etwa Vertreter der Untergattung Odatria in Australien, können von räuberischen Neozoen wie etwa Hauskatzen dezimiert werden.[9] In Australien erleiden größere, Amphibien jagende Warane starke Rückgänge durch die Einbürgerung der Aga-Kröte (Bufo marinus). Die Echsen kennen diese giftige Kröte nicht und sterben an deren Hautgift. Hierzu genügt es, die Kröte beim Beutefang ins Maul zu nehmen. Populationen von großen Waranarten nehmen oft um etwa 90 % ab, wenn Agakröten in ihren Lebensraum einwandern.[112][113]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Varanus In: The Reptile Database
- Varanus in der Roten Liste gefährdeter Arten der IUCN 2010.
- varanidae.org – Webseite der International Varanid Interest Group (IVIG).
- monitor-lizards.net – Webseite, die sich mit Haltung von Waranen befasst.
- VaranID – Bestimmungshilfe für Warane.
- ncbi.nlm.nih.gov – GenBank-Eintrag der Warane.
Literatur
[Bearbeiten | Quelltext bearbeiten]- J. C. Ast (2001): Mitochondrial DNA Evidence and Evolution in Varanoidea (Squamata). Cladistics 17: 211–226.
- W. Auffenberg (1981): The Behavioral Ecology of the Komodo Monitor. University Presses of Florida, Gainesville.
- W. Auffenberg (1988): Gray's Monitor Lizard. University Presses of Florida, Gainesville.
- W. Auffenberg (1994): The Bengal Monitor. University of Florida Press.
- D. Bennett (1996): Warane der Welt. Welt der Warane. Edition Chimaira, Frankfurt am Main. ISBN 3-930612-05-4.
- W. Böhme (2003): Checklist of the living monitor lizards of the world (family Varanidae). Zoologische Verhandelingen 341: 3–43.
- W. Böhme & T. Ziegler (2008): A review of iguanian and anguimorph lizard genitalia (Squamata: Chamaeleonidae; Varanoidea, Shinisauridae, Xenosauridae, Anguidae) and their phylogenetic significance: comparisons with molecular data sets. Journal of Zoological Systematics and Evolutionary Research 47(2): 189–202.
- A. J. Fitch, A. E. Goodman & S. C. Donnellan (2006): A molecular phylogeny of the Australian monitor lizards (Squamata:Varanidae) inferred from mitochondrial DNA sequences. Australian Journal of Zoology 54: 253–269.
- H.-G. Horn & W. Böhme (1991, Hrsg.): Advances in Monitor Research. Mertensiella 2.
- H.-G. Horn & W. Böhme (1999, Hrsg.): Advances in Monitor Research II. Mertensiella 11.
- H.-G. Horn, W. Böhme & U. Krebs (2007, Hrsg.): Advances in Monitor Research III. Mertensiella 16. ISBN 978-3-9806577-9-2.
- D. R. King & B. Green (1999): Monitors: The Biology of Varanid Lizards. Krieger Publishing Company, Malabar. ISBN 1-57524-112-9.
- A. Koch, M. Auliya & T. Ziegler (2010): Updated checklist of the living monitor lizards of the world (Squamata: Varanidae). Bonn Zoological Bulletin 57(2): 127–136
- R. Mertens (1942): Die Familie der Warane (Varanidae). Erster Teil: Allgemeines. Abhandlungen der senckenbergischen naturforschenden Gesellschaft 462: 1–116.
- R. Mertens (1942): Die Familie der Warane (Varanidae). Zweiter Teil: Der Schädel. Abhandlungen der senckenbergischen naturforschenden Gesellschaft 465: 117–234.
- E. R. Pianka & D. R. King (2004, Hrsg.): Varanoid Lizards of the World. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- T. Ziegler & W. Böhme (1997): Genitalstrukturen und Paarungsbiologie bei squamaten Reptilien, speziell den Platynota, mit Bemerkungen zur Systematik. Mertensiella 8: 3–210.
- T. Ziegler, A. Schmitz, A. Koch & W. Böhme (2007): A review of the subgenus Euprepiosaurus of Varanus (Squamata: Varanidae): Morphological and molecular phylogeny, distribution and zoogeography, with an identification key for the members of the V. indicus and the V. prasinus species groups. Zootaxa 1472: 1–28.
Belege
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Varanus In: The Reptile Database; abgerufen am 13. Mai 2020.
- ↑ a b c d e Varanus in der Roten Liste gefährdeter Arten der IUCN 2010. Abgerufen am 1. März 2011.
- ↑ a b c E. R. Pianka & D. R. King (2004): Introduction. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 3–9. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ a b c d e f Div. Artkapitel in E. R. Pianka & D. R. King (2004, Hrsg.): Varanoid Lizards of the World. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ a b c T. Ziegler, A. Schmitz, A. Koch & W. Böhme (2007): A review of the subgenus Euprepiosaurus of Varanus (Squamata: Varanidae): Morphological and molecular phylogeny, distribution and zoogeography, with an identification key for the members of the V. indicus and the V. prasinus species groups. Zootaxa 1472: 1–28.
- ↑ G. Dryden & T. Ziegler (2004): Varanus indicus. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 184–188. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ M. Stanner (2004): Varanus griseus. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 184–188. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ a b c d e f g h i j k l m n o p R. Mertens (1942): Die Familie der Warane (Varanidae). Erster Teil: Allgemeines. Abhandlungen der senckenbergischen naturforschenden Gesellschaft 462: 1–116.
- ↑ a b c d S. S. Sweet & E. R. Pianka (2007): Monitors, Mammals and Wallace's Line. Mertensiella 16 (Advances in Monitor Research III): 79–99.
- ↑ V. S.-A. Weijola (2010): Geographical Distribution and Habitat Use of Monitor Lizards of the North Moluccas. Biawak 4(1): 7–23.
- ↑ V. S.-A. Weijola & S. S. Sweet (2010): A new melanistic species of monitor lizard (Reptilia: Squamata: Varanidae) from Sanana Island, Indonesia. Zootaxa 2434: 17–32.
- ↑ a b A. Koch, M. Gaulke & W. Böhme (2010): Unravelling the underestimated diversity of Philippine water monitor lizards (Squamata: Varanus salvator complex), with the description of two new species and a new subspecies. Zootaxa 2446: 1–54.
- ↑ a b c L. J. Welton, C. D. Siler, D. Bennett, A. Diesmos, M. R. Duya, R. Dugay, E. L. Rico, M. Van Weerd, R. M. Brown: A spectacular new Philippine monitor lizard reveals a hidden biogeographic boundary and a novel flagship species for conservation. In: Biology letters. Band 6, Nummer 5, Oktober 2010, S. 654–658, doi:10.1098/rsbl.2010.0119, PMID 20375042, PMC 2936141 (freier Volltext).
- ↑ M. K. Bayless (2002): Monitor lizards: a pan-African check-list of their zoogeography (Sauria: Varanidae: Polydaedalus). Journal of Biogeography 29(12): 1643–1701.
- ↑ a b c E. R. Pianka (1995): Evolution of body size: varanid lizards as a model system. The American Naturalist 146(3): 398–414.
- ↑ a b E. R. Pianka (2004): Varanus brevicauda. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 312–317. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ a b C. Ciofi (2004): Varanus komodoensis. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 197–204. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ a b c d J. C. Ast (2001): Mitochondrial DNA Evidence and Evolution in Varanoidea (Squamata). Cladistics 17: 211–226.
- ↑ a b c A. J. Fitch, A. E. Goodman & S. C. Donnellan (2006): A molecular phylogeny of the Australian monitor lizards (Squamata:Varanidae) inferred from mitochondrial DNA sequences. Australian Journal of Zoology 54: 253–269.
- ↑ D. Frynta, P. Frýdlová, J. Hnízdo, O. Šimková, V. Cikánová & P. Velenský (2010): Ontogeny of Sexual Size Dimorphism in Monitor Lizards: Males Grow for a Longer Period, but not at a Faster Rate. Zoological Science 27(12): 917–923.
- ↑ J. G. Smith, B. W. Brook, A. D. Griffiths & G. G. Thompson (2007): Can Morphometrics Predict Sex in Varanids? Journal of Herpetology 41(1): 133–140.
- ↑ a b c d E. R. Pianka (2004): Varanus olivaceus. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 220–224. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ a b B. Weavers (2004): Varanus varius. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 488–502. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ W. Maier, L. Olsson & A. Goldschmid (2004): Kopf. In: R. Rieger & W. Westheide (Hrsg.): Spezielle Zoologie Teil 2: Wirbel- oder Schädeltiere. Spektrum Akademischer Verlag, Heidelberg & Berlin. ISBN 3-8274-0307-3.
- ↑ R. Mertens (1942): Die Familie der Warane (Varanidae). Zweiter Teil: Der Schädel. Abhandlungen der senckenbergischen naturforschenden Gesellschaft 465: 117–234.
- ↑ D. C. D’Amore & R. J. Blumenschine (2009): Komodo monitor (Varanus komodoensis) feeding behavior and dental function reflected through tooth marks on bone surfaces, and the application to ziphodont paleobiology. Paleobiology 35(4): 525–552.
- ↑ a b M. Stanner (2010): Mammal-like Feeding Behavior of Varanus salvator and its Conservational Implications. Biawak 4(4): 128–131.
- ↑ S. Lenz (2004): Varanus niloticus. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 133–138. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ a b c d e K. K. Smith (1986): Morphology and Function of the Tongue and Hyoid Apparatus in Varanus (Varanidae, Lacertilia). Journal of Morphology 187(3): 261–287.
- ↑ a b c T. Owerkowicz, C. G. Farmer, J. W. Hicks, E. L. Brainerd (1999): Contribution of Gular Pumping to Lung Ventilation in Monitor Lizards. Science 284: 1661–1663.
- ↑ a b V. L. Bels, J.-P. Gasc, V. Goosse, S. Renous & R. Vernet (1995): Functional analysis of the throat display in the sand goanna Varanus griseus (Reptilia: Squamata: Varanidae). Journal of Zoology 236(1): 95–116.
- ↑ a b c d e f W. Auffenberg (1981): The behavioral ecology of the Komodo monitor. University Press of Florida, Gainesville.
- ↑ a b G. M. Erickson, A. de Ricoles, V. de Buffrenil, R. E. Molnar & M. K. Bayless (2003): Vermiform bones and the evolution of gigantism in Megalania—how a reptilian fox became a lion. Journal of Vertebrate Paleontology 23(4): 966–970.
- ↑ H. Fuchs (1977): Histologie und mikroskopische Anatomie der Haut des Bindenwarans. Stuttgarter Beiträge zur Naturkunde Serie A (Biologie) 299: 1–16.
- ↑ a b W. Böhme (2004): Squamata, Schuppenkriechtiere. In: W. Westheide & R. Rieger (Hrsg.): Spezielle Zoologie Teil 2: Wirbel- oder Schädeltiere: 358–380. Spektrum Akademischer Verlag, Heidelberg & Berlin. ISBN 3-8274-0900-4.
- ↑ a b c d G. Webb, H. Heatwole & J. De Bavay (1971): Comparative cardiac anatomy of the reptilia. I. The chambers and septa of the varanid ventricle. Journal of Morphology 134(3): 335–350.
- ↑ N. Heisler, P. Neumann & G. M. O Maloiy (1983): The mechanism of intracardiac shunting in the lizard Varanus exanthematicus. Journal of Experimental Biology 105: 15–31.
- ↑ a b c d e f g h i j k l m n o p D. R. King & B. Green (1999): Monitors: The Biology of Varanid Lizards. Krieger Publishing Company, Malabar, 2. Aufl. ISBN 1-57524-112-9.
- ↑ H. O. Becker, W. Böhme & S. F. Perry (1989): Die Lungenmorphologie der Warane (Reptilia: Varanidae) und ihre systematisch-stammesgeschichtliche Bedeutung. Bonner zoologische Beiträge 40: 27–56. (online; PDF; 3,5 MB)
- ↑ T. Owerkowicz, E. L. Brainerd & D. R. Carrier (2001): Electromyographic pattern of the gular pump in monitor lizards. Bull. Mus. Comp. Zool. 156: 237–248.
- ↑ M. S. A. D. al-Ghamdi, J. F. X. Jones & E. W. Taylor (2001): Evidence of a functional role in lung inflation for the buccal pump in the agamid lizard, Uromastyx aegyptius microlepis. Journal of Experimental Biology 204: 521–531.
- ↑ Röntgenaufnahme des gular pumping (MOV; 3,0 MB)
- ↑ A. F. Bennett (1973): Blood physiology and oxygen transport during activity in two lizards, Varanus gouldii and Sauromalus hispidus. Comparative Biochemistry and Physiology A 46: 673–690.
- ↑ A. F. Bennett (1973): Ventilation in two species of lizards during rest and activity. Comparative Biochemistry and Physiology A 46: 673–690.
- ↑ a b T. T. Gleeson, G. S. Mitchell & A. F. Bennett (1980): Cardiovascular responses to graded activity in the lizards Varanus and Iguana. In: American Journal of Physiology-Regulatory, Integrative and Comparative Physiology 239: R174-R179.
- ↑ a b c d G. G. Thompson (1999): Goanna Metabolism: Different to Other Lizards, and if so, What are the Ecologocial Consequences? Mertensiella 11 (Advances in Monitor Research II): 79–90.
- ↑ S. C. Wood & K. Johansen (1974): Respiratory adaptations to diving in the nile monitor lizard, Varanus niloticus. Journal of Comparative Physiology A 89(2): 145–158.
- ↑ B. Green & K. Christian (2007): Field Metabolic Rates (FMRs) and Water Fluxes in Free-living Varanid Lizards; A Review. Mertensiella 16 (Advances in Monitor Research III): 240–246.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z D. Bennett (1996): Warane der Welt. Welt der Warane. Edition Chimaira, Frankfurt am Main. ISBN 3-930612-05-4.
- ↑ a b J. A. Phillips (1995): Movement patterns and density of Varanus albigularis. Journal of Herpetology 29: 407–416.
- ↑ B. Röll & H.-G. Horn (1999): The structure of the eye of the monitor lizard Varanus griseus caspius (Reptilia, Varanidae). Mertensiella 11 (Advances in Monitor Research II): 291–306.
- ↑ R. G. Sprackland (1999): Character Displacement among Sympatric Varanid Lizard Species: A Study of Natural Selection and Systematics in Action (Reptilia: Squamata: Varanidae). Mertensiella 11 (Advances in Monitor Research II): 113–120.
- ↑ C. Traeholt (1997): Effect of masking the parietal eye on the diurnal activity and body temperature of two sympatric species of monitor lizards, Varanus s. salvator and V. b. nebulosus. Journal of Comparative Physiology B 167: 177–184.
- ↑ a b c B. G. Fry, N. Vidal, J. A. Norman, F. J. Vonk, H. Scheib, S. F. R. Ramjan, S. Kuruppu, K. Fung, S. B. Hedges, M. K. Richardson, W. C. Hodgson, V. Ignjatovic, R. Summerhayes & E. Kochva (2006): Early evolution of the venom system in lizards and snakes. Nature 439: 584–588.
- ↑ a b B. G. Fry, K. Winter, J. A. Norman, K. Roelants, R. J. A. Nabuurs, M. J. P. van Osch, W. M. Teeuwisse, L. van der Weerd, J. E. McNaughtan, H. F. Kwok, H. Scheib, L. Greisman, E. Kochva, L. J. Miller, F. Gao, J. Karas, D. Scanlon, F. Lin, S. Kuruppu, C. Shaw, L. Wong & W. C. Hodgson (2010): Functional and Structural Diversification of the Anguimorpha Lizard Venom System. Molecular & Cellular Proteomics 9: 2369–2390.
- ↑ B. G. Fry & H. Scheib (2007): Venom Breathing Dragons: The Molecular Diversity of Protein Toxines in Varanid Venoms. Mertensiella 16 (Advances in Monitor Research III): 10–24.
- ↑ a b B. G. Fry, S. Wroe, W. Teeuwisse, M. J. P. van Osch, K. Moreno, J. Ingle, C. McHenry, T. Ferrara, P. Clausen, H. Scheib, K. L. Winter, L. Greisman, Kim Roelants, L. van der Weerd, C. J. Clemente, E. Giannakis, W. C. Hodgson, S. Luz, P. Martelli, K. Krishnasamy, E. Kochva, H. F. Kwok, D. Scanlon, J. Karas, D. M. Citron, E. J. C. Goldstein, J. E. Mcnaughtan & Janette A. Norman (2009): A central role for venom in predation by Varanus komodoensis (Komodo Dragon) and the extinct giant Varanus (Megalania) priscus. PNAS 106(22): 8969–8974.
- ↑ a b K. Arbuckle (2009): Ecological Function of Venom in Varanus, with a Compilation of Dietary Records from the Literature. Biawak 3(2): 46–56.
- ↑ a b H. Preuschoft, U. Witzel, B. Hohn, D. Schulte & C. Distler (2007): Biomechanics of Locomotion and Body Structure in Varanids with Special Emphasis on the Forelimbs. Mertensiella 11 (Advances in Monitor Research III): 59–78.
- ↑ A. Christian (2007): Scaling Effects in Monitor Lizards and Consequences for the Evolution of Large Size in Terrestrial Vertebrates. Mertensiella 16 (Advances in Monitor Research III): 1–9.
- ↑ J. O. Farlow & E. R. Pianka (2000): Body Form and Trackway Pattern in Australian Desert Monitors (Squamata: Varanidae): Comparing Zoological and Ichnological Diversity. PALAIOS 15(3): 235–247.
- ↑ G. G. Thompson (1995): Foraging patterns and behaviours, body postures and movement speed for goannas, Varanus gouldii (Reptilia: Varanidae), in a semi-urban environment. Journal of the Royal Society of Western Australia 78: 107–114.
- ↑ a b K. Christian (2004): Varanus panoptes. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 423–429. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ H.-G. Horn (2007): Transmission and Reflection Spectra of Shed Skin of Various Varanids in the UV, VIS and IR and their Intra- and Interspecific Meaning. Mertensiella 16 (Advances in Monitor Research III): 291–303.
- ↑ a b c E. R. Pianka (1994): Comparative Ecology of Varanus in the Great Victoria Desert. Australian Journal of Ecology 19: 395–408.
- ↑ M. Gaulke & H.-G. Horn (2004): Varanus salvator (Nominate Form). In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World, S. 244–257. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ S. S. Sweet (2004): Varanus glauerti. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 366–372. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ a b c d R. L. Earley, O. Attum & P. Eason (2002): Varanid combat: perspectives from game theory. Amphibia-Reptilia 23: 469–485.
- ↑ G. W. Schuett, R. S. Reiserer & R. L. Earley (2009): The evolution of bipedal postures in varanoid lizards. Biological Journal of the Linnean Society 97(3): 652–663.
- ↑ a b U. Krebs (2007): On Intelligence in Man and Monitor: Observations, Concepts, Proposals. Mertensiella 16 (Advances in Monitor Research III): 44–58.
- ↑ a b c H.-G. Horn (1999): Evolutionary Efficiency and Succes in Monitors: A Survey on Behavior and Behavioral Strategies and some Comments. Mertensiella 11 (Advances in Monitor Research II): 167–180.
- ↑ a b c d e f J. B. Losos & H. W. Greene (1988): Ecological and evolutionary implications of diet in monitor lizards. Biological Journal of the Linnean Society 35(4): 379–407.
- ↑ W. Auffenberg (1988): Gray's Monitor Lizard. University Presses of Florida, Gainesville.
- ↑ a b M. Gaulke, A. V. Altenbach, A. Demegillo & U. Struck (2007): On the Diet of Varanus mabitang. Mertensiella 16 (Advances in Monitor Research III): 228–239.
- ↑ P. J. Mayes, G. G. Thompson & P. C. Whiters (2005): Diet and foraging behavior of Varanus mertensi (Reptilia:Varanidae). Wildlife Research 32: 67–74.
- ↑ R. Shannon & R. W. Mendyk (2009): Aquatic Foraging Behavior and Freshwater Mussel (Velesunio sp.) Predation by Varanus panoptes panoptes in Central-Western Queensland. Biawak 3(3): 85–87.
- ↑ H. de Lisle (2007): Observations on Varanus s. salvator in North Sulawesi. Biawak 1(2): 59–66.
- ↑ L. J. Mendis Wickramasinghe, L. D. C. Bhathiya Kekulandala, P. I. Kumara Peabotuwage & D. M. S. Suranjan Karunarathna (2010): A Remarkable Feeding Behavior and a New Distribution Record of Varanus salvator salvator (Laurenti, 1768) in Eastern Sri Lanka. Biawak, 4(3): 93–98.
- ↑ K. H. Andres, M. von Düring & H.-G. Horn (1999): Fine Structure of Scale Glands and Preanal Glands of Monitors Varanidae. Mertensiella 11 (Advances in Monitor Research II): 277–290.
- ↑ a b G. G. Thompson & E. R. Pianka (2001): Allometry of Clutch and Neonate Sizes in Monitor Lizards (Varanidae: Varanus). Copeia 2001(2): 443–458.
- ↑ P. Rismiller, M. W. McKelvey & S. Steinlechner (2007): Temperature and humidity in Egg Incubation Mounds of Varanus rosenbergi. Mertensiella 16 (Advances in Monitor Research III): 353–363.
- ↑ a b c R. Wiechmann (2011): Eigene Beobachtungen zur Parthenogenese bei Waranen. elaphe 19(1): 55–61.
- ↑ B. Green, M. McKelvey & P. Rismiller (1999): The Behavior and Energetics of Hatchling Varanus rosenbergi. Mertensiella 11 (Advances in Monitor Research II): 105–112.
- ↑ P. W. Lenk, B. Eidenmüller, H. Stauder, R. Wicker & M. Wink (2005): A parthenogenetic Varanus. Amphibia-Reptilia 26: 507–514.
- ↑ P. C. Watts, K. R. Buley, S. Sanderson, W. Boardman, C. Ciofi & R. Gibson (2006): Parthenogenesis in Komodo Dragons. Nature 444: 1021–1022.
- ↑ J. Hennessy (2010): Parthenogenesis in an Ornate Nile Monitor, Varanus ornatus. Biawak 4(1): 26–30.
- ↑ M. K. Bayless (2007): A Revised List of Ixodid Ticks Known to the Yemen Monitor (Varanus yemenensis); with a Review of the Ixodid Tick (Ixodoidea) Species Known to African and Arabian Monitor Lizards [Varanidae: Polydaedalus]. Biawak 1(2): 67–72.
- ↑ a b Robert Alexander Pyron, Frank T. Burbrink & John J. Wiens: A phylogeny and revised classification of Squamata, including 4161 species of lizards and snakes. BMC Evolutionary Biology 2013, 13:93 doi:10.1186/1471-2148-13-93
- ↑ Lanthanotus borneensis In: The Reptile Database
- ↑
Einige Arbeiten zur Systematik der Schleichenartigen:
- J. C. Ast (2001): Mitochondrial DNA Evidence and Evolution in Varanoidea (Squamata). Cladistics 17: 211–226.
- J. L. Conrad (2008): Phylogeny And Systematics Of Squamata (Reptilia) Based On Morphology. Bulletin of the American Museum of Natural History 310: 1–182.
- J. L. Conrad, O. Rieppel & L. Grande (2008): Re-assessment of varanid evolution based on new data from Saniwa ensidens Leidy, 1870 (Squamata, Reptilia). American Museum Novitates 3630 :1–15.
- J. L. Conrad, J. C. Ast, S. Montanari & M. A. Norell (2010): A combined evidence phylogenetic analysis of Anguimorpha (Reptilia: Squamata). Cladistics 26: 1–48.
- B. G. Fry, N. Vidal, J. A. Norman, F. J. Vonk, H. Scheib, S. F. R. Ramjan, S. Kuruppu, K. Fung, S. B. Hedges, M. K. Richardson, W. C. Hodgson, V. Ignjatovic, R. Summerhayes & E. Kochva (2006): Early evolution of the venom system in lizards and snakes. Nature 439: 584–588.
- M. S. Y. Lee (2005): Molecular evidence and marine snake origins. Biology Letters 1: 27–30
- O. Rieppel & H. Zaher (2000): The braincases of mosasaurs and Varanus, and the relationships of snakes. Zoological Journal of the Linnean Society 129: 489–514.
- N. Vidal & S. B. Hedges (2004): Molecular evidence for a terrestrial origin of snakes. Proceedings of the Royal Society of London B 271: 226-S229.
- ↑ a b A. Koch, M. Auliya & T. Ziegler (2010): Updated checklist of the living monitor lizards of the world (Squamata: Varanidae). Bonn Zoological Bulletin 57(2): 127–136.
- ↑ a b T. Ziegler & W. Böhme (1997): Genitalstrukturen und Paarungsbiologie bei squamaten Reptilien, speziell den Platynota, mit Bemerkungen zur Systematik. Mertensiella 8: 3–210.
- ↑ W. Böhme (2003): Checklist of the living monitor lizards of the world (family Varanidae). Zoologische Verhandelingen 341: 3–43.
- ↑ W. Böhme & T. Ziegler (2008): A review of iguanian and anguimorph lizard genitalia (Squamata: Chamaeleonidae; Varanoidea, Shinisauridae, Xenosauridae, Anguidae) and their phylogenetic significance: comparisons with molecular data sets. Journal of Zoological Systematics and Evolutionary Research 47(2): 189–202.
- ↑ a b c d R. E. Molnar (2004): The Long and Honorable History of Monitors and Their Kin. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 10–67. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ a b c d e E. Arida & W. Böhme (2010): The Origin of Varanus: When Fossils, Morphology, and Molecules Alone Are Never Enough. Biawak 4(4): 117–124.
- ↑ a b Liping Dong, Yuan-Qing Wang, Qi Zhao, Davit Vasilyan, Yuan Wang and Susan E. Evans. 2020. A New Stem-varanid Lizard (Reptilia, Squamata) from the early Eocene of China. Philosophical Transactions of the Royal Society B: Biological Sciences. 377(1847) DOI: 10.1098/rstb.2021.0041
- ↑ a b c d e S. A. M. Amer & Y. Kumazawa (2008): Timing of a mtDNA gene rearrangement and intercontinental dispersal of varanid lizards. Genes, Genetics and Systematics 83: 275–280.
- ↑ R. B. Holmes, A. M. Murray, Y. S. Attia, E. L. Simons & P. Chatrath (2010): Oldest known Varanus (Squamata: Varanidae) from the Upper Eocene and Lower Oligocene of Egypt: support for an African origin of the genus. Palaeontology 53(5): 1099–1110.
- ↑ African Varanid Species. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World, S. 90. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ T. Ziegler, M. Gaulke & W. Böhme (2005): Genital Morphology and Systematics of Varanus mabitang Gaulke & Curio, 2001 (Squamata: Varanidae). Current Herpetology 24(1): 13–17.
- ↑ S. A. Hocknull, P. J. Piper, G. D. van den Bergh, R. A. Due, M. J. Morwood & I. Kurniawan (2009): Dragon's Paradise Lost: Palaeobiogeography, Evolution and Extinction of the Largest-Ever Terrestrial Lizards (Varanidae). PLoS ONE 4(9): e7241.
- ↑ J. J. Head, P. M. Barrett & E. J. Rayfield (2009): Neurocranial osteology and systematic relationships of Varanus (Megalania) prisca Owen, 1859 (Squamata: Varanidae). Zoological Journal of the Linnean Society 155(2): 445–457.
- ↑ a b V. de Buffrénil & G. Hémery: Harvest of the Nile Monitor, Varanus niloticus, in Sahelian Africa. Part I: Impact of Intensive Harvest on Local Stocks. Mertensiella 16 (Advances in Monitor Research III): 181–194.
- ↑ A. P. Pernetta (2009): Monitoring the Trade: Using the CITES Database to Examine the Global Trade in Live Monitor Lizards (Varanus spp.). Biawak 3(2): 37–45.
- ↑ A. Koch (2010): Bestialische Behandlung indonesischer Großreptilien für westliche Luxusprodukte. Reptilia 15(6): 3, 6.
- ↑ I. Das (1989): Indian monitor lizards: A review of human utilisation patterns. Hamadryad 14(1): 16–19.
- ↑ J.-B. Fauvel & A. Koch (2009): Zoo-Ethnological Observations in Southwest Sulawesi, Indonesia: a case Study of Kembar Buaya ("Monitor Twins"). Biawak, 3(3): 77–80.
- ↑ H.-G. Horn (2004): Keeping Monitors in Captivity: A Biological, Technical, and Legislative Problem. In: E. R. Pianka & D. R. King (Hrsg.): Varanoid Lizards of the World: 556–571. Indiana University Press, Bloomington & Indianapolis. ISBN 0-253-34366-6.
- ↑ a b Appendices I, II and III. Cites, abgerufen am 28. März 2011.
- ↑ A. Koch (2010): Unterschätzt und ausgebeutet: Systematik, Diversität und Endemismus südostasiatischer Bindenwarane. Koenigiana 4(1): 27–41.
- ↑ J. S. Doody, B. Green, R. Sims & D. Rhind (2007): A Preliminary Assessment of the Impacts of Invasive Cane toads (Bufo marinus) on Three Species of Varanid Lizards in Australia. Mertensiella 16 (Advances in Monitor Research III): 218–227.
- ↑ B. Ujvari & T. Madsen (2009): Increased mortality of naive varanid lizards after the invasion of non-native cane toads (Bufo marinus). Herpetological Conservation and Biology 4(2): 248–251.
