Cyclopropancarbonsäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyclopropancarbonsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H6O2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 86,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
vollständig mit Wasser mischbar,[4] löslich in Diethylether[5] | |||||||||||||||
| Brechungsindex |
1,4390 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Cyclopropancarbonsäure ist das kleinste Cycloalkan, das eine Carboxygruppe trägt, die direkt mit der Cyclopropylgruppe verknüpft ist. Die Verbindung ist Ausgangsstoff für pharmazeutische Wirkstoffe, Pestizide und Aromastoffe.
Natürliche Vorkommen und Herstellung
[Bearbeiten | Quelltext bearbeiten]Das Strukturelement der (3-Alkenyl-2,2-dimethyl-substiutierten)-Cyclopropancarbonsäure findet sich in den natürlich vorkommenden insektiziden Pyrethrinen und den daraus abgeleiteten synthetischen Pyrethroiden[6], sowie in der nichtproteinogenen Aminosäure Aminocyclopropancarbonsäure.[7]
Die chemische Synthese der Cyclopropancarbonsäure erfolgt durch vollständige Hydrolyse der Nitrilgruppe des Cyclopropancarbonitrils mit Schwefelsäure über die Zwischenstufe des Carbonsäureamids[8] oder biochemisch mit Enzymzubereitungen aus Rhodococcus-Stämmen[9] und liefert das Zielprodukt in 74 bis 79 %iger bzw. ca. 90%iger Ausbeute.
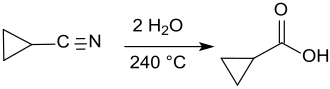
Bei der Luftoxidation von Cyclopropancarbaldehyd werden Ausbeuten von Cyclopropancarbonsäure bis 92 % erzielt.[10]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Cyclopropancarbonsäure ist eine organische Carbonsäure mit stechendem Geruch und einer mit der linearen C3-Säure Propionsäure (pKs = 4,87) fast identischen Acidität. In wässriger Lösung (10 g·l−1 bei 22 °C) beträgt ihr pH-Wert 3.[1] Die Verbindung löst sich in Alkoholen und in den meisten organischen Lösungsmitteln.
Anwendungen
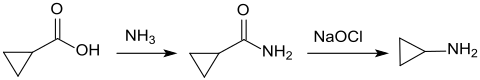
[Bearbeiten | Quelltext bearbeiten]Unter Druck (45 bar) und hohen Temperaturen (240 °C) wird aus Cyclopropancarbonsäure und Ammoniak Cyclopropancarboxamid in 90 %iger Ausbeute gebildet.[10]
Cyclopropylamin ist durch Reaktion von Cyclopropancarbonsäure mit Phosphortrichlorid zum Cyclopropancarbonylchlorid, dessen Amidierung mit Ammoniak zum Cyclopropancarboxamid und weitere Hofmann-Umlagerung mit Brom und Natronlauge (unter Bildung von Natriumhypobromit) in 82 %iger Ausbeute zugänglich.[11]
Der durch Veresterung von Cyclopropancarbonsäure mit Ethanol in 98 %iger Ausbeute erhältliche Ethylester Ethylcyclopropancarboxylat[10] ist Ausgangsstoff in der mehrstufigen Synthese des Antipsychotikums Pimozid.[12]
Höhere Ester der Cyclopropancarbonsäure eignen sich als Riechstoffe und Aromen, wie z. B. der cis-3-Hexenolester, dem ein ausgeprägtes „Regenwald“-Aroma zugeschrieben wird.[13]

Die Umsetzung des Cyclopropylcarbonsäureethylesters mit Toluol unter Friedel-Crafts-Acylierungsbedingungen liefert 2-Methyl-1-indanon in 93 %iger Ausbeute,[14]

einer Zwischenstufe für die ringerweiternde Synthese (mittels Umsetzung mit n-Butylnitrit) von Isochinolonen (auch als Isocarbostyrile[15] bezeichnet), deren Grundgerüst sich in einigen Alkaloiden wiederfindet.
Bei der Hydrierung von Cyclopropancarbonsäureethylester an einem Zinkoxid-Kontakt entsteht Cyclopropylmethanol in fast quantitativer Ausbeute,[16] das in einer Eintopfreaktion mit Salzsäure unter Ringerweiterung zum Cyclobutanol umgelagert und anschließend mit Chrom(VI)-oxid mit Ausbeuten von ca. 35 % zum Cyclobutanon oxidiert werden kann.[17]
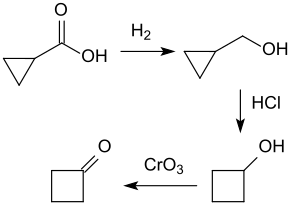
Dieser Syntheseweg scheint einen günstigen und einfachen Zugang zu Cyclobutanon zu bieten.
Das mit Thionylchlorid aus Cyclopropancarbonsäure erhältliche Cyclopropancarbonylchlorid[10] findet Verwendung in der Synthese des Opioid-Analgetikums Buprenorphin, des Opioidantagonisten Naltrexon und des Benzodiazepins Prazepam. Es ist außerdem ein Baustein für die Herbizide Cyprazol, Cypromid und Cyclosulfamuron und das Fungizid Cyprofuram.[18]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Datenblatt Cyclopropancarbonsäure zur Synthese bei Merck, abgerufen am 28. Januar 2018.
- ↑ a b c Datenblatt Cyclopropancarbonsäure bei Sigma-Aldrich, abgerufen am 28. Januar 2018 (PDF).
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 5–90.
- ↑ a b Datenblatt Cyclopropanecarboxylic acid, 98% bei Alfa Aesar, abgerufen am 28. Januar 2018 (Seite nicht mehr abrufbar).
- ↑ C.M. McCloskey, G.H. Coleman: Cyclopropanecarboxylic acid In: Organic Syntheses. 24, 1944, S. 36, doi:10.15227/orgsyn.024.0036; Coll. Vol. 3, 1955, S. 221 (PDF).
- ↑ N. Matsuo, T. Mori (Hrsg.): Pyrethroids, From Chrysanthemum to Modern Industrial Insecticide, Topics in Current Chemistry 314. Springer, Berlin 2007, ISBN 978-3-642-27345-2.
- ↑ F. Brackmann, A. de Meijere: Natural occurrence, syntheses, and applications of cyclopropyl-group-containing α-amino acids. 1. 1-Aminocyclopropanecarboxylic acid and other 2,3-methanoamino acids. In: Chem. Rev. Band 107, Nr. 11, 2007, S. 4493–4537, doi:10.1021/cr078376j.
- ↑ C.M. McCloskey, G.H. Coleman: Cyclopropanecarboxylic acid In: Organic Syntheses. 24, 1944, S. 36, doi:10.15227/orgsyn.024.0036; Coll. Vol. 3, 1955, S. 221 (PDF).
- ↑ M.A. Cohen, J. Sawden, N.J. Turner: Selective hydrolysis of nitriles under mild conditions by an enzyme. In: Tetrahedron Lett. Band 31, Nr. 49, 1990, S. 7223–7226, doi:10.1016/S0040-4039(00)97285-X.
- ↑ a b c d Patent US5663418: Process for the preparation of cyclopropanecarboxylic acid and derivatives thereof. Angemeldet am 27. November 1995, veröffentlicht am 2. September 1997, Anmelder: Eastman Chemical Co., Erfinder: S. Liang, T.W. Price.
- ↑ W. Kirmse, O. Schnurr, H. Jendralla: Desaminierungsreaktionen, 33. Reaktionen aliphatischer Diazonium-Ionen mit Lithiumazid. In: Chem. Ber. Band 112, Nr. 6, 1979, S. 2120–2144, doi:10.1002/cber.19791120621.
- ↑ R. Vardanyan, V. Hruby: Synthesis of Essential Drugs. Elsevier B.V., Amsterdam 2006, ISBN 978-0-444-52166-8, S. 96.
- ↑ Patent EP0869111A1: Cyclopropyl carboxylic acid ester and uses thereof in imparting, augmenting and enhancing aromas. Angemeldet am 6. Februar 1998, veröffentlicht am 7. Oktober 1998, Anmelder: International Flavors & Fragrances, Inc., Erfinder: M.G. Monteleone, G.I. Malcolm, M.R. Hanna, M.D. Evans.
- ↑ H.W. Pinnick, S.P. Brown, E.A. McLean, L.W. Zoller III: Friedel-Crafts reactions of ethyl cyclopropane carboxylate. In: J. Org. Chem. Band 46, Nr. 18, 1981, S. 3758–3760, doi:10.1021/jo00331a046.
- ↑ E.J. Moriconi, F.J. Creegan: 2-Hydroxy-2-methylisocarbostyril In: Organic Syntheses. 48, 1968, S. 90, doi:10.15227/orgsyn.048.0090; Coll. Vol. 5, 1973, S. 63 (PDF).
- ↑ Patent EP0728722A1: Verfahren zur Herstellung von Hydroxymethyl-cyclopropan. Angemeldet am 8. Februar 1996, veröffentlicht am 28. August 1996, Anmelder: Bayer AG, Erfinder: L. Frohn, R. Langer, G. Darsow, E. Zirngiebl, J.-D. Jentsch, B. Pennemann, C. Tiburtius.
- ↑ M. Krumpolc, J. Rocek: Cyclobutanone In: Organic Syntheses. 60, 1981, S. 20, doi:10.15227/orgsyn.060.0020; Coll. Vol. 7, 1990, S. 114 (PDF).
- ↑ Compendium of Pesticide Common Names, http://www.alanwood.net/pesticides/index.html

