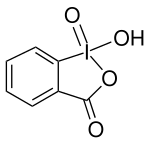
2-Iodoxybenzoesäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Iodoxybenzoesäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C7H5IO4 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 280,02 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in den meisten organischen Lösungsmitteln[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
2-Iodoxybenzoesäure (kurz IBX) ist eine chemische Verbindung aus der Gruppe der hypervalenten Iodverbindungen und findet Anwendung als Oxidationsmittel in der organischen Synthese.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Verbindung wurde erstmals 1893 durch Christoph Hartmann und Victor Meyer durch Reaktion von Oxidation von 2-Iodbenzoesäure mit Kaliumpermanganat synthetisiert. Die chemische Struktur wurde 1936 von F. R. Greenbaum aufgeklärt.[1] In der organischen Synthese hatte die Verbindung lange Zeit kaum Bedeutung, da sie in den meisten organischen Lösungsmitteln unlöslich ist. In den 1990er-Jahren wurde entdeckt, dass Dimethylsulfoxid als Lösungsmittel geeignet ist, um Oxidationsreaktionen mit der Verbindung durchzuführen, sodass sie inzwischen synthetische Anwendung findet.[3] Die Veröffentlichung zu dieser Verwendung von Iodoxybenzoesäure trägt den Titel Oxidation of Alcohols with o-Iodoxybenzoic Acid (IBX) in DMSO: A New Insight into an Old Hypervalent Iodine Reagent.[4]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]2-Iodoxybenzoesäure kann durch den Dess-Martin-Prozess durch Reaktion von 2-Iodbenzoesäure mit Schwefelsäure und Kaliumbromat bei 55 °C gewonnen werden.[5] Eine neuere Herstellungsmethode verwendet Kaliumperoxomonosulfat („Oxone“) als Oxidationsmittel.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2-Iodoxybenzoesäure ist ein weißer kristalliner Feststoff mit intensiv saurem Geschmack, der unlöslich in den meisten organischen Lösungsmitteln ist,[1] jedoch löslich in Dimethylsulfoxid.[3] Die Verbindung zersetzt sich bei 233 °C explosiv;[1] durch Verunreinigungen kann ihre Zersetzungstemperatur deutlich absinken, so kann sie in feuchtem Zustand schon ab 130 °C explodieren.[3] Das technische Produkt kommt beispielsweise mit Benzoesäure stabilisiert in den Handel,[2] eine andere stabilisierte Zubereitungsform enthält Benzoesäure und Isophthalsäure.[3] Die Verbindung ist nach dem SprengG als explosionsgefährlich eingestuft und wurde der Stoffgruppe C zugeordnet.[6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Die Oxidation von Alkoholen mit hypervalenten Iodverbindungen, neben 2-Iodoxybenzoesäure vor allem mit dem Dess-Martin-Periodinan, ist eine wichtige Methode zur Umwandlung primärer Alkohole in Aldehyde und sekundärer Alkohole in Ketone. 2-Iodoxybenzoesäure ist auch der synthetische Vorläufer bei der Herstellung des Dess-Martin-Periodinans, das durch Umsetzung mit Essigsäure und Acetanhydrid gewonnen wird.[3] Neben der Oxidation von Alkoholen eignet sich 2-Iodoxybenzoesäure auch für die Oxidation von Aminen zu Iminen verwendet.[7] Unter geeigneten Reaktionsbedingungen können verschiedene Oxidationen durchgeführt werden, die sonst schwierig zu bewerkstelligen sind. Dazu gehört die Oxidation von Glycolen zu 1,2-Dicarbonylverbindung unter Vermeidung einer Glycolspaltung, die Oxidation von 1,4-Diolen zu einem cyclischen Halbacetal (Lactol), ohne Weiteroxidation zu einem Lacton, sowie die selektive Oxidation von Alkoholen in Gegenwart von Aminen.[3]

Es wird auch für andere chemische Reaktionen, so zur Beseitigung von VX-Kampfstoffen und für Dehydrierungen zu Enonen, für Oxygenierungen und für weitere oxidative Prozesse eingesetzt.[1][8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f uni-heidelberg.de: Neue Anwendungen von IBX, abgerufen am 12. September 2015.
- ↑ a b c d e Datenblatt 2-Iodoxybenzoic acid, contains stabilizer, 45 wt. % (IBX) bei Sigma-Aldrich, abgerufen am 12. September 2015 (PDF).
- ↑ a b c d e f g Gabriel Tojo, Marcos Fernandez: Oxidation of alcohols to aldehydes and ketones: a guide to current common practice (= Basic reactions in organic synthesis). Springer, New York, NY 2006, ISBN 978-0-387-23607-0.
- ↑ Marco Frigerio, Marco Santagostino, Simona Sputore, Giovanni Palmisano: Oxidation of Alcohols with o-Iodoxybenzoic Acid in DMSO: A New Insight into an Old Hypervalent Iodine Reagent. In: The Journal of Organic Chemistry. Band 60, Nr. 22, November 1995, S. 7272–7276, doi:10.1021/jo00127a036.
- ↑ W. L. F. Armarego, Christina Li Lin Chai: Purification of Laboratory Chemicals. Butterworth-Heinemann, 2013, ISBN 0-12-382161-4, S. 998 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Bekanntmachung der gemäß § 2 SprengG von der BAM seit 1987 neu getroffenen Feststellungen - Feststellungsbescheid Nr. 470 vom 25. November 2009 pdf-Link.
- ↑ K. C. Nicolaou, C. J. N. Mathison, T. Montagnon: New Reactions of IBX: Oxidation of Nitrogen‐ and Sulfur‐Containing Substrates to Afford Useful Synthetic Intermediates In: Angew. Chem. 115, 2003, S. 4211–4216, doi:10.1002/ange.200352076.
- ↑ Alexander Duschek, Stefan F. Kirsch: 2-Iodoxybenzoesäure - ein einfaches Oxidationsmittel mit einer Vielfalt an Anwendungsmöglichkeiten. In: Angewandte Chemie. 123, 2011, S. 1562, doi:10.1002/ange.201000873.


