„Hämostase“ – Versionsunterschied
| [ungesichtete Version] | [ungesichtete Version] |
Leflic (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
Leflic (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| Zeile 196: | Zeile 196: | ||
* {{Literatur|Autor=Joachim Rassow, Karin Hauser, Roland Netzker|Titel=Biochemie|Auflage=1.|Verlag=Thieme|Ort=Stuttgart|Jahr=2006|ISBN=3131253517}} |
* {{Literatur|Autor=Joachim Rassow, Karin Hauser, Roland Netzker|Titel=Biochemie|Auflage=1.|Verlag=Thieme|Ort=Stuttgart|Jahr=2006|ISBN=3131253517}} |
||
* {{Literatur|Autor=Werner Müller-Esterl|Titel=Biochemie. Eine Einführung für Mediziner und Naturwissenschaftler|Auflage=1.|Verlag=Spektrum Akademischer Verlag|Ort=Frankfurt|Jahr=2004|ISBN=3827405343}} |
* {{Literatur|Autor=Werner Müller-Esterl|Titel=Biochemie. Eine Einführung für Mediziner und Naturwissenschaftler|Auflage=1.|Verlag=Spektrum Akademischer Verlag|Ort=Frankfurt|Jahr=2004|ISBN=3827405343}} |
||
* |
* {{Literatur|Autor=Roland Scholz|Titel=Medizinische Biochemie|Band=Kap.11/12 : Biotransformation: Fremdstoffe, Häm, Cholesterin. Blutgerinnung und Fibrinolyse |Auflage=1.|Verlag=Zuckerschwerdt|Ort=München|Jahr=2003|ISBN=388603822X}} |
||
* Schmidt, Lang, |
* {{Literatur|Autor=Robert F. Schmidt, Florian Lang, Gerhard Thews|Titel=Physiologie des Menschen|Band=Cholesterin. Blutgerinnung und Fibrinolyse|Auflage=29.|Verlag=Springer|Ort=Berlin|Jahr=2004|ISBN=3540218823}} |
||
== Weblinks == |
== Weblinks == |
||
Version vom 4. Oktober 2007, 21:26 Uhr
Die Hämostase (auch Blutstillung, Stypsis) ist ein physiologischer Prozess, der eine Blutung infolge einer Verletzung des Blutgefäßsystems zum Stehen bringt. Sie ist ein lebenswichtiger Mechanismus, der den übermäßigen Austritt von Blut aus dem Blutkreislauf verhindert und ferner Voraussetzung für die Wundheilung.
Die Blutgerinnung muss bei gesunden Lebewesen zusammenfassend folgende Voraussetzungen erfüllen: Sie muss im Falle einer Verletzung hinreichend schnell, das heißt innerhalb weniger Minuten, einsetzen um größeren Blutverlust zu vermeiden, letztendlich zu einem Blutungsstopp führen, auf den Bereich der Verletzung beschränkt bleiben und darf nicht fälschlicherweise durch andere Ereignisse wie Entzündungen oder Infektionen ausgelöst werden.
Bei dem körpereigenen Vorgang sind die Blutplättchen (Thrombozyten), die innere Auskleidung des betroffenen Blutgefäßes (Gefäßendothel), Gewebe außerhalb des Gefäßes sowie im Blutplasma regulär enthaltene Gerinnungsfaktoren beteiligt. Vereinfacht dargestellt verengt sich das Gefäß zunächst, dann haften Thrombozyten an das Leck, verkleben untereinander und stellen so den ersten Wundverschluss her, der als primäre Blutstillung oder zelluläre Hämostase bezeichnet wird. Dieser lose Verschluss wird durch die Aktivierung des plasmatischen Gerinnungssystems ergänzt, welches einen festen Pfropfen aus Fibrin bildet, der sich nach abgeschlossener Gerinnung zusammenzieht. Dies wird sekundäre Blutstillung oder plasmatische Hämostase genannt.
Fibringerinnsel werden später durch das fibrinolytische System (Plasmin) des Blutplasmas aufgelöst, die gleichzeitig einsetzende Wundheilung wird durch sogenannte Wachstumsfaktoren aus Thrombozyten und Endothelzellen begonnen.
Es existieren blutstillende Mittel (Hämostatika), die körperweit wirken wie Vitamin K oder lokal wirken wie Adrenalin, welches die Blutgefäße am Applikationsort verengt. Andererseits gibt es Mittel, die der Blutgerinnung entgegenwirken (ugs. Blutverdünner), wie z. B. Heparin und Cumarine (Antikoagulantien) die das plasmatische System beeinflussen, sowie Acetylsalicylsäure (ASS, u.a. Aspirin®), die zu den Thrombozytenaggregationshemmern gezählt wird. Ein genetischer Defekt von Gerinnungsfaktoren kann zu Krankheiten wie der Hämophilie führen.
Dieser Artikel beschreibt die Hämostase beim Menschen. Die Aussagen treffen überwiegend auch auf andere Säugetiere zu, aber nur eingeschränkt auf andere Tierklassen.
Physiologische Vorgänge nach einer Gefäßverletzung
Nach Verletzung kleinerer Gefäße kommt eine Blutung üblicherweise zügig zum Stehen. Die dafür verantwortliche Hämostase kann als Abfolge der folgenden Prozesse betrachtet werden (vereinfacht):
- Vaskuläre Hämostase: Verringerung des Gefäßdurchmessers (Vasokonstriktion); verringert Blutdurchsatz und damit Blutverlust.
- Zelluläre Hämostase: Anheftung (Adhäsion), Verkleben (Aggregation), und Aktivierung weiterer Thrombozyten, Bildung eines verschließenden, weißen Thrombozytenthrombus.
- Plasmatische Hämostase: Bestandteile des Blutplasmas erzeugen ein Maschenwerk aus mechanisch stabilen Fibrinfäden, das einen roten Thrombus bildet, der sich schließlich verfestigt und zusammenzieht (kontrahiert).
Zwischen diesen Systemen bestehen enge funktionelle und zeitliche Beziehungen. Daher ist die scharfe Grenzziehung in erster Linie als didaktisch motiviert zu betrachten. In vivo (also im Körper) sind die Vorgänge eng mit- und ineinander verzahnt und lassen sich nicht derart scharf unterteilen.
Zelluläre Hämostase

Das Blut eines Menschen enthält im Normalfall zwischen 150.000 und 400.000 Thrombozyten pro Mikroliter.[1] Eine Verringerung dieser Zahl wird als Thrombozytopenie) bezeichnet. Aufgrund besonderer Eigenschaften der inneren Auskleidung der Blutgefäße (der Glykokalyx des Blutgefäßendothels), für welche die Thrombozyten keine Rezeptoren haben, verbleiben sie innerhalb unverletzter Gefäße inaktiv. Dies wird unterstützt durch verschiedene Faktoren, die einer Aktivierung der Thrombozyten entgegenwirken (Beispiele: Heparin, Stickstoffmonoxid).
Thrombozytenadhäsion und Aktivierung
Bei Verletzung eines Gefäßes kommt das Blut mit dem umliegenden Gewebe der Blutgefäße in Berührung, es werden dort unter anderem subendotheliale Kollagenfasern freigelegt. Kollagen ist ein Strukturprotein das nahezu überall im Extrazellularraum vorhanden ist. An diese Fasern heften sich die Thrombozyten an (Thrombozytenadhäsion). Die Anheftung wird durch den von-Willebrand-Faktor (vWF) vermittelt und führt zu einer ersten Adhäsion der Thrombozyten und zur Ausbildung einer dünnen Bedeckung der Wunde[2].
Der von-Willebrand-Faktor ist ein lösliches Blutprotein, welches von Endothelzellen und Megakaryozyten gebildet wird und zusammen mit Fibronektin und Laminin eine Verbindung zwischen Kollagenfasern und einem spezifischen Rezeptorkomplex auf der Thrombozytenmembran (GP Ib/IX) herstellt. Ein Defekt dieses Mechanismus tritt beim Bernard-Soulier-Syndrom auf.
Nach Anlagerung der Thrombozyten an das freigelegte subendotheliale Gewebe werden die Blutplättchen aktiviert und „locken“ weitere Thrombozyten an. Bei der Aktivierung werden verschiedene Stoffe freigesetzt, welche als Agonisten weitere freie Thrombozyten aktivieren (Ca2+, ADP, Serotonin und Thromboxan A2). Ebenfalls wird der Inhalt der elektronendichten α-Granula der Thrombozyten ausgeschüttet: Gerinnungsfaktoren (Faktor V, Faktor VIII), Klebstoffe (vWF, Fibronektin, Thrombospondin) und Wachstumsfaktoren. Durch Aktivierung verschiedener Stoffwechselwege werden außerdem vermehrt Substanzen wie Thromboxan A2 und der PAF (Platelet Activating Factor, plättchenaktivierender Faktor) gebildet.
Die Stoffe haben verschiedene Wirkungen, beispielsweise hat das ausgeschüttete und vermehrt gebildete Thromboxan A2 eine gefäßverengende Wirkung, was ebenfalls zur Stillung der Blutung beiträgt. Einige der Stoffe induzieren u. a. die plasmatische Gerinnung.
Thrombozytenaggregation
- Hauptartikel: Thrombozytenaggregation
Die Thrombozytenaggregation besteht aus einer Umorganisation der Thrombozytenmembran und einer Formveränderung des Blutplättchens mithilfe des Zytoskeletts.
Aktivierte Thrombozyten verändern (mittels Actin- und Myosinfilamenten) ihre Form. Ca2+-induziert wird beispielsweise globuläres Aktin in fibrilläres Aktin umgewandelt. Während die Thrombozyten inaktiv Linsenform haben, nehmen sie im aktiven Zustand Kugelform an und tragen dabei lange Pseudopodien (Schein-Füßchen), mit deren Hilfe sie sich untereinander einhaken können – die Thrombozyten werden „stachelig“ und „klebrig“.
Die aktivierten Thrombozyten bilden schließlich einen Thrombozyten-Pfropf (Thrombozytenaggregation). Dieses Aggregat wird als weißer Thrombus bezeichnet. Mit der Aggregation der Thrombozyten endet die zelluläre Hämostase. Normalerweise dauert der Prozess eine bis vier Minuten, diese Dauer wird als Blutungszeit bezeichnet.
Nach Aktivierung eines Thrombozyten wird ein Rezeptorkomplex auf der Thrombozytenmembran bereitgestellt (Glycoprotein IIb/IIIa), an welchen Plasmafibrinogen und die aus den aktivierten Thrombozyten freigesetzten Haftstoffe (Fibrinogen, Thrombospondin) binden. Es entsteht somit ein Aggregat aus Thrombozyten. Rückkopplungsmechanismen der ausgeschütteten Stoffe führen schließlich zu einer irreversiblen Aggregation, bei der die Zellmembranen der Thrombozyten miteinander verschmelzen. [3]
Plasmatische Hämostase
Der durch die zelluläre Hämostase (primäre Blutstillung) zügig gebildete weiße Thrombus ist nicht allzu stabil und kann weggeschwemmt werden. Einen festeren Verschluss stellt die Plasmatische Hämostase her: Sie bildet ein Maschenwerk aus mechanisch festem Fibrin, in das neben Thrombozyten auch rote Blutkörperchen (Erythrozyten) eingefangen werden, daher „roter Thrombus“. Diese sekundäre Blutstillung ist die eigentliche Blutgerinnung und wird ebenfalls als Gerinnungskaskade bezeichnet. Sie wird in drei Phasen unterteilt: Aktivierungs-, Koagulations- und Retraktionsphase.
Aktivierungsphase
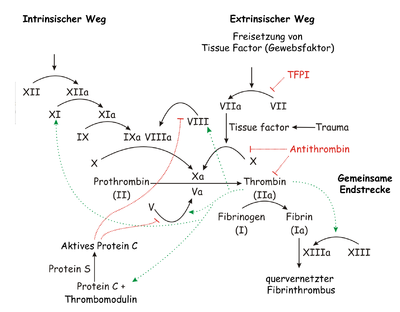
Es existieren zwei Mechanismen differenziert, welche die plasmatische Hämostase starten können: Ein exogener und ein endogener Mechanismus. Diese Unterteilung gilt jedoch als veraltet. Sie basiert teilweise auf heute als falsch angesehenen Voraussetzungen. Das modernere System ist zellbasiert [4]). Beide Mechanismen führen letztendlich zur Aktivierung von Faktor X, welcher wiederum zur Bildung von Thrombin (Faktor II) führt, welches für die Polymerisation von Fibrin und damit die Bildung des Maschenwerkes („roter Thrombus“) verantwortlich ist. Siehe dazu die Abbildung rechts.
Extrinsisches System (Exogener Mechanismus)
Der exogene Mechanismus wird durch Kontakt von Blut mit Gewebethromboplasmin (Tissue Factor, TF) aus verletztem subendothelialem Gewebe initiiert. Der Tissue Factor ist ein Membranprotein, welches beispielsweise in der Adventitia von Blutgefäßen vorkommt – von Endothelzellen selbst wird er nur nach Aktivierung freigesetzt. Dieser bildet einen Komplex mit Faktor XII, der in seine aktive Form überführt wird. Durch die Aktivierung von Faktor XII wird die Aktivierung der Faktoren IX und VIII, die gemeinsam einen Komplex bilden, induziert. Der Komplex von IX und VIII aktiviert für sich die Ausbildung eines Komplexes der Faktoren V und X. Prothrombin (Faktor II) wird von Faktor Xa gespalten, wobei Thrombin (Faktor IIa, also aktivierter Faktor II) entsteht (siehe Abbildung rechts). Diese Reaktion findet nur in Anwesenheit von Calcium auf der mit Phospholipiden besetzten Thrombozyten-Membran statt und wird durch Rückkopplung mit dem Komplex der Faktoren VIII und IX stark beschleunigt.
Intrinsisches System (Endogener Mechanismus)
Durch den Kontakt mit negativ geladenen Oberflächen wie zum Beispiel Glas werden die Faktoren XII und XI aktiviert, die ebenfalls eine Gerinnungskaskade in Gang setzen (siehe Abbildung rechts). Man geht heute davon aus, dass dies physiologisch unbedeutend ist. [5] Wird der Faktor XI bei einem Individuum nicht gebildet hat das keine Störung der Gerinnung zur Folge.
Auch beim endogenen Mechanismus wird schließlich Prothrombin (Faktor II) von Faktor Xa gespalten, wobei Thrombin (Faktor IIa, also aktivierter Faktor II) entsteht. Beide Mechanismen münden also in die selbe Endstrecke (siehe Abbildung rechts).
Koagulations- und Retraktionsphase
Die Aktivierungsphase endet mit der Bildung von enzymatisch aktivem Thrombin (Faktor IIa). In der folgenden Koagulationsphase spaltet Thrombin aus Fibrinogen (Faktor I), der inaktiven Vorstufe des Blutproteins Fibrin, niedermolekulare Einheiten (Fibrinopeptide), welche Fibrinmonomere bilden, die sich nichtkovalent zu einem Fibrinpolymer zusammenlagern. Durch Wirkung des Faktors XIII werden zwischen den Monomeren schließlich kovalente Bindungen geknüpft und der Thrombus stabilisiert. Das Fibrin vernetzt die schon aneinandergelagerten Thrombozyten und festigt damit den Wundverschluss. In das Netz werden rote Blutkörperchen eingefangen, ein sogenannter roter Thrombus bildet sich. Das Thrombin bewirkt weiterhin eine Kontraktion des Aktin-Myosin-Skeletts innerhalb der Thrombozyten: Die sich kontrahierenden Thrombozyten ziehen am Fibrinnetz und somit die Wundränder zusammen und verschließen die Wunde mechanisch. Durch das Zusammenziehen und unterstützt durch den PDGF (platelet-derived growth factor) wird außerdem das Eindringen von Bindegewebszellen, die der Wundheilung dienen, gefördert.
Das Fehlen der Faktoren VIII oder IX führt zur Hämophilie, der Bluterkrankheit. Durch das Fehlen dieser Faktoren wird die Kaskade unterbrochen und die Verstärkung der Gerinnung bleibt aus, was fatale Folgen haben kann. Die Patienten können an kleinsten inneren Verletzungen verbluten.
Übergang zur Wundheilung
- Hauptartikel: Wundheilung, Fibrinolyse
Infolge der plasmatischen Hämostase erfolgt die Wundheilung, indem Bindegewebsbildner (Fibroblasten) in den Thrombus einwachsen und ihn bindegewebig umbauen. Dabei sterben beschädigte Zellen ab und werden abgebaut.
Für den Abbau der Thromben ist vor allem ein Protein namens Plasmin zuständig, das ebenfalls durch kompliziert regulierte Mechanismen aus einer inaktiven Vorstufe (Plasminogen) gebildet wird. Plasmin löst die kovalenten Bindungen zwischen den Fibrin-Strängen auf und damit das Netz, das den Thrombus festhält.
Zwischen den Systemen der Blutgerinnung und dem System der Fibrinolyse (die die Aufgabe hat, den roten Thrombus im Gefäßsystem wieder aufzulösen) bestehen abgestimmte Gleichgewichte. Geringfügige Störungen dieser Gleichgewichte können zu schwerwiegenden Blutungen oder zur Bildung von Thromben an Orten führen, an denen keine Verletzung vorliegt.
Gerinnungsfaktoren
Gerinnungsfaktoren sind Eiweißstoffe (Proteine) im menschlichen Blut. Ihre biologische Funktion besteht darin, nach Aktivierung mit den Blutplättchen zu verkleben und entstandene Lecks im Gefäßsystem dadurch abzudichten (s.o.) Jedem Faktor ist eine römische Zahl zugewiesen.
Ein kleines a hinter der Zahl bedeutet, dass er in der aktiven Form vorliegt. Aus historischen Gründen existiert VI nicht mehr, er entspricht Va.
| Nummer | Name(n) | Funktion |
|---|---|---|
| I | Fibrinogen | bildet das Fibrinnetz |
| II | Prothrombin | Die aktive Form Thrombin (IIa) aktiviert die Faktoren I, V, VII und XIII. |
| III | Thromboplastin, Tissue factor (TF) | im subendothelialen Gewebe, Kofaktor von VIIa. |
| IV | Calcium | Viele Faktoren benötigen das Kalzium-Kation Ca2+, um an die negativ geladenen Phospholipide der Plasmamembranen zu binden. |
| V | Proaccelerin | Kofaktor von X, mit dem es einen Komplex bildet. |
| VII | Proconvertin | aktiviert IX und X, wird durch Kontakt mit TF aktiviert |
| VIII | Antihämophiles Globulin A | Kofaktor von IX, mit dem es einen Komplex bildet |
| IX | Christmas-Faktor, Antihämophiles Globulin B | aktiviert X, bildet einen Komplex mit VIII. |
| X | Stuart-Prower-Faktor | aktiviert Prothrombin, bildet einen Komplex mit VII |
| XI | Rosenthal-Faktor, Plasma Thromboplasmin Antecedent (PTA) | aktiviert XII und IX |
| XII | Hageman-Faktor | aktiviert die Fibrinolyse |
| XIII | Fibrinstabilisierender Faktor | stabilisiert Fibrin durch Bildung von Quervernetzungen |
Gerinnungshemmung in vivo und in vitro
- Der Hauptartikel zu Medikamenten zur Gerinnungshemmung findet sich unter Antikoagulation
Das Blutplasma enthält Proteaseinhibitoren, welche die Bildung von Fibrin hemmen. Antithrombin III ist der bedeutendste Hemmer mehrerer Gerinnungsproteasen in der Aktivierungsphase und Koagulationsphase. Die inhibitorische Wirkung wird durch seinen Kofaktor, das Heparin, deutlich verstärkt. Heparin wird im Körper von Endothelzellen und Mastzellen gebildet. Ein Stoff namens Thrombomodulin, der ebenfalls aus dem Endothel stammt, bindet an Thrombin und aktiviert Protein C, einen Inhibitor, der nach Bindung an Protein S die Cofaktoren Va und VIIIa inaktiviert.
Zur medikamentören Gerinnungshemmung in vivo können Heparin und Heparinoide eingesetzt werden. Es handelt sich um eine extrem stark negativ geladenes Kette aus Zuckern, die sich an das schon erwähnte Protein Antithrombin III heftet. Dieser Komplex bindet nun wirksamer die Faktoren Thrombin und Xa, die außer Kraft gesetzt werden: Die Gerinnungskaskade kommt zum Erliegen. Die Wirkung setzt nach intravenöser Gabe sofort ein. Heparin wird üblicherweise aus tierischen Geweben gewonnen.
Eine weitere Möglichkeit sind sogenannte Vitamin-K-Antagonisten wie Cumarin. Vitamin K wird zur Synthese der meisten Gerinnungsfaktoren als Coenzym benötigt. Cumarin wirkt in der Leber und verhindert die Reduktion von Vitamin K (Phyllochinon). Dieses wirkt bei der γ-Carboxylierung der Gerinnungsfaktoren (II, VII, IX, X) mit und wird dabei selbst oxidiert (Abgabe von Elektronen). Ohne eine darauf folgende Reduktion (Aufnahme von Elektronen) bleibt Vitamin K funktionslos. Die Wirkung setzt zwar erst nach einer gewissen Zeit ein, dafür kann die Gabe oral erfolgen.
Acetylsalicylsäure (Aspirin) kann in die Thrombozytenaggregation, also in die primäre Hämostase, eingreifen. Eine Cyclooxygenase (COX), die für die Synthese des Plättchenfaktors Thromboxan A2 benötigt wird, wird irreversibel durch Anheftung eines Essigsäure-Restes gehemmt.
In vitro, z. B. in Blutröhrchen, kommen häufig EDTA und Citrat zum Einsatz, Chelatoren, die einen unlöslichen Komplex mit den zur Gerinnung nötigen Kalzium-Kationen bilden. Eine Gerinnungshemmung mit Heparin ist in vitro ebenfalls möglich. Die Auswahl des Gerinnungshemmers erfolgt nach dem Gesichtspunkt, welche Untersuchung später mit dem ungerinnbar gemachten Blut geplant ist. Für Untersuchungen der Gerinnung selbst wird fast ausschließlich Citrat als Gerinnungshemmer verwendet.
Inhibitoren
Mehrere Mechanismen kontrollieren die Gerinnungskaskade. Abweichungen können hier zu einem erhöhten Risiko einer Thrombose führen.
- Protein C ist ein wichtiger Inhibitor der Cofaktoren Va und VIIIa. Protein C wird durch Thrombin aktiviert und braucht selbst ein Coenzym (Protein S) um zu funktionieren.
- Antithrombin blockiert die Serin-Proteasen der Gerinnunskaskade, vor allem Thrombin aber auch Xa, XIIa und IXa. Es ist dauerhaft aktiv, aber die Bindung von Heparin kann seine Wirkung verstärken (siehe unten).
Forschungsgeschichte
Die ersten Theorien zur Blutgerinnung beruhten vor allem auf der Humoralpathologie. Man brachte die Gerinnung mit schwarzer Galle in Verbindung. Ab dem 17. Jahrhundert wurde mit der Untersuchung der physiologischen und molekularen Mechanismen begonnen.[6] Alexander Schmidt (1831-1894) stellte 1876 eine Gerinnungstheorie auf, die auf miteinander wechselwirkenden Proteinen basierte. Auch die Rolle des Kalziums wurde von ihm beschrieben.[7] Lange wurde diskutiert, welche Stoffe zur Gerinnung wirklich nötig sind und ob die zelluläre und die plasmatische Phase die bedeutendere ist.
Im Jahr 1904 beschrieb Paul Morawitz das System schon fast so, wie wie es heute bekannt ist. Er prägte den Begriff der plasmatischen Gerinnung und beschrieb die folgenden zwei Phasen:
Die molekularen Mechanismen der Blutgerinnung wurden zum größten Teil im Laufe des 20. Jahrhunderts entdeckt. Ein erster Hinweis auf die Komplexität der Mechanismen der Blutgerinnung war die Entdeckung von Proaccelerin durch Paul Owren (1905-1990) im Jahre 1947, welches als Faktor V bezeichnet wurde. Die komplette Aminosäuresequenz wurde 1987 durch Jenny et al. veröffentlicht.[8] Owren vermutete bereits, dass dieser Faktor Accelerin produziert, das er als Faktor VI bezeichnete. Später stellt sich heraus, dass V die inaktive Vorstufe von VI ist. Deshalb wird Faktor VI nun als Va bezeichnet.
Der Faktor IX wurde 1952 in einem jungen Patientin mit Hämophilie B namens Stephen Christmas entdeckt und heißt deshalb Christmas-Faktor.[9] Amerikanische Forscher entdeckten, dass das Fehlen eben dieses Faktors die Krankheit auslöste.
Viele der anderen Faktoren wurden ebenfalls in den 1950er-Jahren entdeckt und häufig nach den Patienten benannt, in denen sie gefunden wurden. Deshalb existieren noch viele Trivialnamen. Details zu deren Entdeckung lassen sich bei den jeweiligen Artikeln der einzelnen Faktoren finden.
Erst in neuer Zeit wurde entdeckt, dass der intrinsische Weg in der Physiologie wohl keine Rolle spielt.[10]
Klinische Bedeutung
Gerinnungszeit
Zur Bestimmung der Gerinnungszeit dienen in der labormedizinischen Diagnostik
- der Quick-Wert (der zunehmend von der INR ersetzt wird) zur selektiven Funktionsbestimmung des exogenen Systems durch Zugabe von Tissue-Faktor zur Blutprobe, beispielsweise bei einer Cumarintherapie und
- die PTT (Partial Thromboplastine Time) zur selektiven Funktionsbestimmung des endogenen Systems und des gemeinsamen Weges der Blutgerinnung.[11]

Diese beiden Untersuchungen werden als Globalteste der Gerinnung bezeichnet. Sie können nur ein Zuwenig an Gerinnung und die meisten damit verbundenen Krankheiten erkennen und zur Überwachung einer Behandlung dienen, nicht jedoch ein Zuviel (Thrombophilie). Für die Thrombophilie existiert zur Zeit kein geeigneter Suchtest, vielmehr müssen bei entsprechendem Verdacht alle möglichen Ursachen einzeln ausgeschlossen werden.
Eine Beurteilung des Quick-Werts und der PTT im Zusammenhang mit einer Blutungsneigung sollte immer die Zahl und ggf. Funktion der Blutplättchen (Thrombozyten) mit einbeziehen.
Arterielles Blut gerinnt schneller als venöses, was auf die Differenzen im Gasgehalt zurückzuführen ist. Die Gerinnung arteriellen Bluts kann durch Zuführung von Kohlensäure verlangsamt, die des Venenbluts aber durch Vermehrung seines Sauerstoffgehalts beschleunigt werden. Die Verschiedenheiten in der Temperatur der beiden Blutarten sind viel weniger regelmäßig, denn während in Organen mit sehr lebhaftem Stoffwechsel (z. B. Drüsen und Muskeln) das abfließende Blut wärmer ist als das eintretende, zeigen Organe mit nur unbedeutenden Wärmebildungsvermögen (z. B. die äußere Haut) ein umgekehrtes Verhalten.
Bedeutung bei Krankheiten
Grundsätzlich kann das Gleichgewicht zwischen Blutstillung und Fibrinolyse in zwei entgegengesetzte Richtungen entgleisen: Das Zuviel an Gerinnung wird als Thrombophilie bezeichnet (die dabei entstehenden, Krankheit verursachenden Blutgerinnsel werden als Thrombus beziehungsweise Embolus bezeichnet), das Zuwenig als Blutungsneigung (hämorrhagische Diathese). Patienten, denen Faktoren des endogenen Weges Fehlen, zeigen keine Symptome.
Blutungsneigung
Das Fehlen von vielen Gerinnungsfaktoren der plasmatischen und zellulären Gerinnung kann zu teilweise lebensbedrohlichen Krankheiten führen, wie zum Beispiel dem Willebrand-Jürgens-Syndrom. Bei Erbkrankheiten wie Hämophilie sind bestimmte Faktoren aufgrund genetischer Defekte nicht oder nur wenig ausgeprägt. Dies betrifft mit Abstand am häufigsten den Gerinnungsfaktor VIII (Hämophilie A), selten auch den Gerinnungsfaktor IX (Hämophilie B). Ein ausgeprägter Mangel an Blutplättchen (Thrombozytopenie) führt ebenfalls zu einer Blutungsneigung.
Eine disseminierte intravasale Koagulation ist eine lebensbedrohliche Erkrankung, bei der durch einen abnormal hohen Spiegel körpereigener Botenstoffe wie Histamin, Serotonin und Adrenalin eine übermäßig stark ablaufende Blutgerinnung stattfindet.
Thrombophilie
Es gibt eine Vielzahl an angeborenen und erworbenen Krankheiten, bei denen eine erhöhte Gerinnungsneigung besteht. Alle haben gemeinsam, dass es vermehrt zu Gefäßverschlüssen wie Thrombosen und Embolien kommt. Bei manchen Erkrankungen ist das Hochdrucksystem der Schlagadern (Arterien) stärker betroffen, bei anderen das Niederdrucksystem der Venen. Die häufigsten und wichtigsten Thrombophilien sind:
- Faktor-V-Leiden (APC-Resistenz)
- Prothrombinmutation G20210A
- Antiphospholipid-Syndrom
- erhöhtes Homocystein
Siehe auch
Neben den körpereigenen Vorgängen können auch äußere Handlungen als Maßnahmen zur Blutstillung betrachtet werden, siehe dazu Blutstillung.
Einzelnachweise und Quellen
- ↑ Schmidt, Lang, Thews: Physiologie des Menschen, 29. Auflage, Heidelberg 2005; S. 524
- ↑ Blood coagulation (en)
- ↑ Deetjen, Speckman, Hescheler: Physiologie, 4. Auflage, München 2005; S. 366
- ↑ Rassow, Hauser, Netzger: Biochemie, Stuttgart 2006; S. 742
- ↑ Physiologie der Blutstillung
- ↑ Historische Konzepte zur Physiologie der Blutgerinnung, Uni Heidelberg
- ↑ Historische Konzepte zur Physiologie der Blutgerinnung, Uni Heidelberg
- ↑ Jenny RJ, Pittman DD, Toole JJ, Kriz RW, Aldape RA, Hewick RM, Kaufman RJ, Mann KG. Complete cDNA and derived amino acid sequence of human factor V. Proc Natl Acad Sci U S A. 1987;84:4846-50. PMID 3110773
- ↑ R. A. Biggs, A. S. Douglas, R. G. MacFarlane, J. V. Dacie, W. R. Pittney, C. Merskey and J. R. O’Brien: Christmas disease, a condition previously mistaken for haemophilia. British Medical Journal, London, 1952: 1378-1382
- ↑ Werlhof-Institut: Physiologie der Gerinnung
- ↑ B. Luxembourg et. al.: Basiswissen Gerinnungslabor Deutsches Ärzteblatt 104, Ausgabe 21 vom 25.05.2007, Seite A-1489
Literatur
- Joachim Rassow, Karin Hauser, Roland Netzker: Biochemie. 1. Auflage. Thieme, Stuttgart 2006, ISBN 3-13-125351-7.
- Werner Müller-Esterl: Biochemie. Eine Einführung für Mediziner und Naturwissenschaftler. 1. Auflage. Spektrum Akademischer Verlag, Frankfurt 2004, ISBN 3-8274-0534-3.
- Roland Scholz: Medizinische Biochemie. 1. Auflage. Kap.11/12 : Biotransformation: Fremdstoffe, Häm, Cholesterin. Blutgerinnung und Fibrinolyse. Zuckerschwerdt, München 2003, ISBN 3-88603-822-X.
- Robert F. Schmidt, Florian Lang, Gerhard Thews: Physiologie des Menschen. 29. Auflage. Cholesterin. Blutgerinnung und Fibrinolyse. Springer, Berlin 2004, ISBN 3-540-21882-3.


