„Ethinyl(triisopropyl)silan“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K →Verwendung: Halbsatz ergänzt |
Leyo (Diskussion | Beiträge) K korr laut Beleg |
||
| Zeile 24: | Zeile 24: | ||
| CLH = <!-- {{CLH-ECHA|ID= |Name= |Datum= }}--> |
| CLH = <!-- {{CLH-ECHA|ID= |Name= |Datum= }}--> |
||
| Quelle GHS-Kz = <ref name="SIGMA">{{Sigma-Aldrich|ALDRICH|360031|Name=(Triisopropylsilyl)acetylene|Abruf=2023-03-12}}</ref> |
| Quelle GHS-Kz = <ref name="SIGMA">{{Sigma-Aldrich|ALDRICH|360031|Name=(Triisopropylsilyl)acetylene|Abruf=2023-03-12}}</ref> |
||
| GHS-Piktogramme = {{GHS-Piktogramme| |
| GHS-Piktogramme = {{GHS-Piktogramme|02|07}} |
||
| GHS-Signalwort = Achtung |
| GHS-Signalwort = Achtung |
||
| H = {{H-Sätze|226|315|319|335}} |
| H = {{H-Sätze|226|315|319|335}} |
||
Version vom 20. Juni 2023, 10:47 Uhr
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
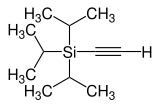
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ethinyl(triisopropyl)silan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H22Si | ||||||||||||||||||
| Kurzbeschreibung |
klare Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 182,38 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,813 g·cm−3[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Ethinyl(triisopropyl)silan (IUPAC-Nomenklatur, Trivialname: Triisopropylsilylacetylen, Akronym: TIPSA) ist eine chemische Verbindung aus der Gruppe der Organosilane.
Gewinnung und Darstellung
Ethinyl(triisopropyl)silan wurde erstmals 1983 von T. K. Jones und S. E. Denmark aus Ethinylmagnesiumbromid[2] und Triisopropylsilylchlorid hergestellt.[3]
Verwendung
Ethinyl(triisopropyl)silan kann in der Sonogashira-Kupplung verwendet werden, um terminale Alkine an ein Arylhalogenid anzufügen. Vorteilhaft ist hier die Stabilität der TIPS-Schutzgruppe auf dem entstehenden terminalen Alkin gegenüber dem in der Suzuki-Miyaura-Kupplung eingesetztem Caesiumcarbonat, sodass beispielsweise eine Ein-Topf-Reaktion, bei der eine Masuda-Borylierung im ersten mit einer Suzuki-Miyaura-Kupplung im zweiten Schritt und einer abschließenden Sonogashira-Kupplung möglich wird (Masuda-Suzuki-Sonogashira-Synthese), ohne das Caesiumcarbonat vor dem letzten Schritt zu entfernen.[4] Dieser Umstand grenzt das Ethinyl(triisopropyl)silan gegenüber Analoga wie Trimethylsilylacetylen ab, da die TMS-Schutzgruppe auf terminalen Alkinen gegenüber Alkalien unbeständig ist.[5]
Sicherheitshinweise
Ethinyl(triisopropyl)silan hat einen Flammpunkt von 56 °C.[1]
Siehe auch
Einzelnachweise
- ↑ a b c d e f g Datenblatt (Triisopropylsilyl)acetylene bei Sigma-Aldrich, abgerufen am 12. März 2023 (PDF).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Ethinylmagnesiumbromid: CAS-Nummer: 4301-14-8, EG-Nummer: 610-098-2, ECHA-InfoCard: 100.121.936, PubChem: 4071243, ChemSpider: 18502062, Wikidata: Q72477798.
- ↑ T. K. Jones, S. E. Denmark: Silicon-Directed Nazarov Reactions III. Stereochemical and Mechanistic Considerations. In: Helvetica Chimica Acta. Band 66, Nr. 8, 1893, S. 2397–2411, doi:10.1002/hlca.19830660803.
- ↑ D. Drießen, L. Biesen, T. J. J. Müller: Sequentially Catalyzed Three-Component Masuda–Suzuki–Sonogashira Synthesis of Fluorescent 2-Alkynyl-4-(7-azaindol-3-yl)pyrimidines: Three Palladium-Catalyzed Processes in a One-Pot Fashion. In: Synlett. Band 32, Nr. 05, 2021, S. 491–496, doi:10.1055/s-0040-1707818.
- ↑ S. Singh, J.-I. Goo, H. Noh, S. J. Lee, M. W. Kim, H. Park, H. B. Jalani, K. Lee, C. Kim, W.-K. Kim et al.: Discovery of a novel series of N-hydroxypyridone derivatives protecting astrocytes against hydrogen peroxide-induced toxicity via improved mitochondrial functionality. In: Bioorganic & Medicinal Chemistry. Band 25, Nr. 4, 2017, S. 1394–1405, doi:10.1016/j.bmc.2016.12.052.


