„Radikalische Polymerisation mit reversibler Deaktivierung“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
→Reversibler Addition-Fragmentierungs-Kettentransfer (RAFT): Kombination aus <chem> und \ce brachte den Artikel in die Wartungskategorie "veraltetes Format des chem-Tags", daher durch < math > ersetzt |
|||
| Zeile 166: | Zeile 166: | ||
Da bei der Reaktion keine Radikale erzeugt oder zerstört werden, ist eine externe Radikalquelle als Radikalstarter erforderlich für eine fortschreitende Reaktion. |
Da bei der Reaktion keine Radikale erzeugt oder zerstört werden, ist eine externe Radikalquelle als Radikalstarter erforderlich für eine fortschreitende Reaktion. |
||
;Radikalinitiierung bei der RAFT polymerization: |
;Radikalinitiierung bei der RAFT polymerization: |
||
:< |
:<math title="Initiation step">\mathrm{I \longrightarrow I^\cdot \xrightarrow{ \ M \ } \xrightarrow{ \ M \ } {P}^\cdot_\mathit{n}}</math> |
||
:<math title="Initiation step">\mathrm{I \longrightarrow I^\cdot \xrightarrow{ \ M \ } \xrightarrow{ \ M \ } P^\cdot P^\cdot x_\mathit{n}}</math> |
|||
;Reversibler Kettentransfer |
;Reversibler Kettentransfer |
||
:[[Datei:RAFT ReversibleChainTransfer.png|500px|Reversible chain transfer]] |
:[[Datei:RAFT ReversibleChainTransfer.png|500px|Reversible chain transfer]] |
||
;Abfangen des Radikals |
;Abfangen des Radikals |
||
:< |
:<math title="Reinitiation step">\mathrm{R^\cdot \xrightarrow{ \ M \ } RM^\cdot \xrightarrow{ \ M \ } \xrightarrow{ \ M \ } {P}^\cdot_\mathit{m}}</math> |
||
;Kettengleichgewichtsreaktion |
;Kettengleichgewichtsreaktion |
||
:[[Datei:RAFT ChainEquilibration.png|450px|Chain equilibration step]] |
:[[Datei:RAFT ChainEquilibration.png|450px|Chain equilibration step]] |
||
;Ende |
;Ende |
||
:< |
:<math title="Termination step">\mathrm{{P}^\cdot_\mathit{m} + {P}^\cdot_\mathit{n} \longrightarrow P_\mathit{m}P_\mathit{n}}</math> |
||
=== Katalytischer Kettentransfer und Kobalt-gesteuerte Radikalische Polymerisation === |
=== Katalytischer Kettentransfer und Kobalt-gesteuerte Radikalische Polymerisation === |
||
Version vom 11. Mai 2020, 21:49 Uhr
| Dieser Artikel wurde auf der Qualitätssicherungsseite der Redaktion Chemie eingetragen. Dies geschieht, um die Qualität der Artikel aus dem Themengebiet Chemie formal und inhaltlich auf ein in der Wikipedia gewünschtes Niveau zu bringen. Wir sind dankbar für deine Mithilfe, bitte beteilige dich an der Diskussion (neuer Eintrag) oder überarbeite den Artikel entsprechend. |
Radikalpolymerisation mit reversibler Deaktivierung (engl. Reversible-deactivation radical polymerization = RDRP) gehört zu der Klasse der Polymerisationen mit reversibler Deaktivierung, die ein wenig den Charakter einer „lebenden Polymerisation“ haben, aber nicht als solche einsortiert werden können ohne Kettenwachstum oder Kettenabbruch.[1][2][3]
Verschiedene Namen sind in der Literatur zu finden:
- Lebende Radikalpolymerisation
- Lebende freie Radikalreaktion
- Kontrollierte/lebende Radikalpolymerisation
- Kontrollierte Radikalpolymerisation
- Radikalkettenreaktion mit reversibler Deaktivierung
Obwohl der Begriff „Lebende Radikalpolymerisation“ schon früher verwendet wurde, wurde das von der IUPAC nicht empfohlen, weil Radikalpolymerisationen nicht wirklich lebende Prozesse sein können wegen der unvermeidlichen Kettenabbruchreaktion zwischen zwei Radikalen. Der allgemein gebräuchliche Ausdruck „Kontrollierte Radikalkettenreaktion“ ist erlaubt, aber empfohlen werden „Radikalpolymerisation mit reversibler Deaktivierung“ oder „Kontrollierte Radikalkettenraktion mit reversibler Deaktivierung“.
Geschichte und Eigenschaften
RDRP - manchmal missverständlich als „freie“ Radikalpolymerisation bezeichnet – ist einer der meist verwendeten Polymerisationsprozesse seit sie angewandt werden:
- sie kann in Anwesenheit bestimmter funktionaler Gruppen durchgeführt werden
- die Technik ist simpel und einfach zu kontrollieren
- sie ist relativ kostengünstig im Vergleich zu anderen Methoden
- die Reaktionsbedingungen können variieren von Lösungen über Emulsionen bis hin zu Suspensionen
Die Gleichgewichtskonzentration einer wachsenden Polymerkette ist in der Größenordnung von 10−7M und die durchschnittliche Lebensdauer eines einzelnen Polymerradikals vor dem Kettenabbruch liegt bei 5–10 s. Der Nachteil der konventionellen Radikalpolymerisation ist die begrenzte Kontrolle der Kettenarchitektur und die Schwankung des Molekulargewichts und der Zusammensetzung. Im späten 20. Jahrhundert beobachtete man, dass nach Zusatz bestimmter Komponenten (der Radikalketten-Carrier) zu den Polymersystemen ein temporär "schlafender Zustand" erreicht werden konnte.[4] [5]
Dieses hatte Einfluss auf die Verlängerung der Lebenszeit der wachsenden Polymerkette mit Werten, vergleichbar mit der Dauer des Experiments. Jederzeit sind Radikale in einem inaktiven (schlafenden) Zustand, jedoch nicht irreversibel zerstört. Nur ein kleiner Teil von ihnen ist aktiv (wachsend), weil die Rate der Umwandlung vom inaktiven zum aktiven Zustand eines Radikals schneller ist als die Reaktionsgeschwindigkeit, mit der das Kettenwachstum stattfindet. Für alle Ketten gibt es dieselbe Wachstumsrate, das heißt, die Ketten wachsen alle durchschnittlich mit der gleichen Geschwindigkeit. Folglich gilt für Polymerketten für den Polymerisationsgrad das normale Wahrscheinlichkeitsgesetz, die Poissonverteilung, und eine niedrige Auflösungsrate überwiegt.
IUPAC erkennt auch den alternativen Namen "kontrollierte reversible Deaktivierungs-Radikalpolymerisation" als akzeptabel an, vorausgesetzt, dass "kontrolliert" im Kontext spezifiziert wird, was bedeutet, dass in diesem Falle die molekulare Masse und die molekulare Massenverteilung berücksichtigt werden. Diese Typen von Radikalpolymerisationen sind keine "lebenden" Polymerisationen, weil die Kettenabbruchreaktionen nicht ausgeschlossen sind.[1][2][3]
Der Begriff "kontrolliert" bedeutet entweder, dass die Kinetik der Reaktion kontrolliert ist, oder, dass ein bestimmtes polymeres Produkt entsteht, oder beides. Der Ausdruck "kontrollierte Reaktion" wird manchmal verwendet, um eine radikalische Polymerisation oder eine ionische Polymerisation zu beschreiben, wobei die reversible Deaktivierung des Ketten-Carriers eine wesentliche Komponente des Mechanismus ist, die die Kettenfortpflanzung unterbricht, und die die Reaktionskinetik der Polymerisation ebenso beeinflusst wie die strukturellen Aspekte der sich bildenden Makromoleküle, oder beides. Der Ausdruck "kontrollierte radikalische Polymerisation" wird manchmal verwendet, um eine Radikalpolymerisation zu beschreiben, die nach einem bestimmten Mechanismus abläuft, bspw. Atomtransfer- Radikalpolymerisation (ATRP) oder Reversible Additons-Fragmentierungs Kettentransfer- Polymerisation (RAFT). Alle diese und weitere kontrollierte Polymerisationsreaktionen gehören zu der Klasse der reversiblen Deaktivierungs-Radikalreaktionen.
Radikalpolymerisation mit reversibler Deaktivierung im Vergleich
Es gibt eine Art von Radikalpolymerisation mit reversibler Deaktivierung, die sich von der lebenden Polymerisation unterscheidet, außer in den allgemeinen Merkmalen. "Lebende Polymerisation" erfordert die komplette Abwesenheit von Abbruchreaktionen, wogegen die Radikalpolymerisation mit reversibler Deaktivierung eine ähnliche Abbruchreaktion beinhaltet wie die konventionelle Polymerisation mit derselben Konzentration an aktiver Spezies.[1] Folgende Tafel vergleicht die wesentlichen Aspekte:
| Standard Radikalpolymerisation | Lebende Polymerisation | Radikalpolymerisation mit reversibler Deaktivierung | |
|---|---|---|---|
| Konzentration des Initialstarters | nimmt nur langsam ab | nimmt rapide ab | nimmt rapide ab |
| Konzentration des Ketten-Carriers (Number of growing chains) |
nimmt während der Reaktion ab | während der ganzen Reaktion konstant | während der ganzen Reaktion konstant |
| Lebensdauer der wachsenden Kette | dieselbe Dauer wie Gesamtreaktion | dieselbe Dauer wie Gesamtreaktion | |
| Art der Abbruchreaktion | Radikalkombination oder radikalische Disproportionierung |
kein irreversibler Kettenabbruch | Radikale werden reversibel deaktiviert / Kettenabbruch nicht ausgeschlossen |
| Verteilung der molaren Masse | breite Verteilung (Ð >=1.5), Schulz-Zimm Verteilung |
enge Verteilung(Ð <1.5), Poissonverteilung |
enge Verteilung(Ð <1.5), Poissonverteilung |
| "schlafende" Zustände | keine | wenige | vorwiegend |
Allgemeine Eigenschaften
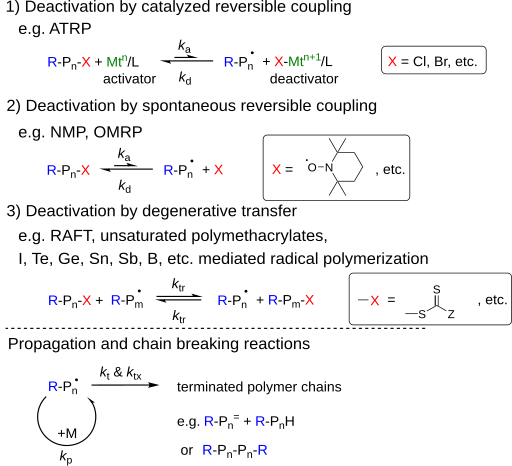
Wie der Name vermuten lässt, ist der Vorteil einer erfolgreichen radikalischen Polymerisation eine schnelle und reversible Aktivierung/Deaktivierung der sich fortpflanzenden Kette. Dabei gibt es drei Typen:
- Deaktivierung durch katalysierte reversible Kupplung
- Deaktivierung durch spontane reversible Kupplung
- Deaktivierung durch degenerativen Transfer (DT)
Eine Mischung der unterschiedlichen Methoden ist möglich z. B.: eine Übergangsmetall-gesteuerten RDRP wechselt zwischen ATRP, OMRP und DT, abhängig von den Reaktionsbedingungen und verwendeten Reagenzien.
In einer RDRP_Reaktion können die Radikale mit einer Reaktionsrate kp unter Addition einiger Monomere reagieren, bevor es zur Deaktivierung kommt, die einen "schlafenden" Zustand erzeugt. Dabei können zwei Radikale miteinander reagieren und unreaktive Ketten mit dem Reaktionskoeffizienten kt erzeugen. Die Reaktionsrate der Kettenfortpflanzung und der Kettenabbruchreaktion zwischen zwei Radikalen wird nicht durch den Mechanismus der Deaktivierung oder durch den verwendeten Katalysator beeinflusst. Kann man also abschätzen, wie die Reaktionsgeschwindigkeit der RDRP durch die Kette und deren funktionelle Gruppen beeinflusst wird?[6]
Zusätzlich gibt es andere Kettenabbruchsreaktionen wie irreversiblen Kettentransfer oder Kettenabbruchsreaktionen des wandernden Radikals mit dem Lösungsmittel, dem Monomer, dem Polymer, dem Katalysator, den Additiven.. was einen zusätzlichen Verlust an Kettenendfunktionalität bedeutet.[7] Die Gesamtreaktionsrate der Kettenabbruchreaktionen neben der direkten Reaktion zweier Radikale wird als ktx bezeichnet.
Bei allen RDRP Methoden kann die theoretische Zahl des durchschnittlichen Molekulargewichts der erhaltenen Polymere Mn durch die folgende Gleichung beschrieben werden:
wobei Mm das Molekulargewicht des Monomers ist; [M]0 und [M]t sind die Monomerkonzentrationen zum Zeitpunkt 0 und zum Zeitpunkt t; [R-X]0 ist die Anfangskonzentration des Initiators (Radikalstarters).
Außer einem bestimmten Molekulargewicht kann eine gut kontrollierte RDRP-Reaktion Polymere mit enger molekularer Verteilung ergeben, die sich in Mw/Mn Werten angeben lassen, und gut vorausbestimmte Ketten und Funktionalitäten.
Eine kontrollierte RDRP_Reaktion erfordert: 1) der Prozess der reversiblen Deaktivierung muss ausreichend schnell sein, 2) die Anzahl der kettenbrechenden Reaktionen, die in Verlust von Kette und Funktionalitäten resultieren, sollte begrenzt sein, 3) die Radikalkonzentration muss aufrechterhalten werden, und 4) der Radikalstarter sollte die geeignete Aktivität haben.
Beispiele
Radikalische Atom-Transfer Polymerisation (ATRP)
Der Radikalstarter der Polymerisation ist normalerweise ein Alkyl- bzw. Arylhalogenid und der "schlafende" Zustand wird durch einen Metallkomplex eines Übergangsmetalls erreicht. Diese Methode ist universell einsetzbar, aber erfordert ungewöhnliche Radikalstartersysteme, die mit dem Polymerisationsmedium schlecht kompatibel sind.
Stickstoffoxid - gesteuerte Polymerisation (NMP)
Unter bestimmten Reaktionsbedingungen kann eine homolytische Spaltung der C-O-Bindung eines Alkoxylamins stattfinden, so dass sich eine stabile 2-Elektronen-3-Zentren-Bindung bildet, die in der Lage ist, eine Polymerisationsreaktion zu starten. Die Vorbedingung für ein Alkoxyamin, das geeignet ist, eine Polymerisation zu starten, ist ein sekundäres Amin mit großen, sterisch hindernden Substituenten und einem Substituenten am Sauerstoffatom, der es ermöglicht, ein stabiles Radikal zu bilden, bzw. Benzyl.

Reversibler Addition-Fragmentierungs-Kettentransfer (RAFT)
RAFT ist die gebräuchlichste und universell einsetzbare Technik in diesem Kontext. Die meisten RAFT-Prozesse werden in der Gegenwart von Thiocarbonylverbindungen durchgeführt, die als Radikalpuffer wirken. Während bei der ATRP und NMP-Technik eine reversible Deaktivierung der fortschreitenden Radikal-Radikal-Reaktion stattfindet und "schlafende" Strukturen aus einem Alkyl-/Arylhalogenid, bzw. einem Alkxoxyamin bei der NMP bestehen, die gleichzeitig Radikalquelle und Radikalfänger sind, und sich durch eine Gleichgewichtsreaktion beschreiben lassen, ist RAFT dagegen eine Technik, die durch Kettentransferreaktionen kontrolliert wird, die in einem Aktivierungs-/Deaktivierungs-Gleichgewicht stehen. Da bei der Reaktion keine Radikale erzeugt oder zerstört werden, ist eine externe Radikalquelle als Radikalstarter erforderlich für eine fortschreitende Reaktion.
- Radikalinitiierung bei der RAFT polymerization
- Reversibler Kettentransfer

- Abfangen des Radikals
- Kettengleichgewichtsreaktion

- Ende
Katalytischer Kettentransfer und Kobalt-gesteuerte Radikalische Polymerisation
Obwohl es strenggenommen keine lebende Polymerisation ist, muss die Katalytische Kettentransfer-Polymerisation in diesem Zusammenhang erwähnt werden, weil sie die Entwicklung der späteren lebenden freien radikalischen Polymerisation verdeutlicht.
Sie wurde in den späten 1970er Jahren entwickelt, als man entdeckte, dass Kobalt-Porphyrine in der Lage sind, während der Polymerisation von Methylacrylaten an Molekulargewicht zu verlieren. Spätere Untersuchungen zeigten, dass Kobalt-Glyoxim-Komplexe genauso effektiv sind wie Porphyrin-Katalysatoren und außerdem weniger sauerstoffempfindlich. Aufgrund der geringeren Sauerstoffempfindlichkeit wurden diese Katalysatoren sorgfältiger untersucht als Porphyrin-Katalysatoren.
Die Hauptprodukte der katalytischen Kettentransfer-Polymerisation sind Vinyl-terminierte Polymerketten. Einer der großen Nachteile des Prozesses ist, dass katalytische Kettentransfer-Polymerisationen keine Makro-Monomere produzieren, sondern stattdessen Additions-Fragmentierungs-Reagenzien. Während eine wachsende Polymerkette mit einem Additionsfragment reagiert, greift die radikalische Endgruppe an der Vinylgruppe an und bildet eine neue Bindung. Das resultierende Produkt ist jedoch sterisch gehindert, sodass die entstandene Spezies einer Fragmentierung unterliegt, die zu einem Telechel-Polymer führt.
Während hohe chemische Ausbeuten an Makro-Monomeren mit Methacrylaten möglich sind, erhält man relativ niedrige Ausbeuten bei Verwendung katalytischer Kettentransfer-Reagenzien während der Polymerisation von Acrylaten und Styrol-Monomeren. Das beruht auf der Wechselwirkung zwischen dem radikalischen Zentrum mit dem Katalysator während der Polymerisationsreaktion. Die reversible Reaktion des Kobalt-Makrozyklus mit wachsenden Radikalketten ist bekannt als Kobalt-Kohlenstoff-Bindung und führt in manchen Fällen zu lebenden Polymerisationen.
Iniferter Polymerization
Ein "Iniferter" ist eine chemische Verbindung, die gleichzeitig als Radikalstarter, Transferreagenz und Terminator in kontrollierten freien Radikal-In-fer-ter-Reaktionen reagiert, daher der Name, dabei ist der Dithiocarbamat-Typ der gebräuchlichste.[8][9]
Iod-Transfer-Polymerisation (ITP)
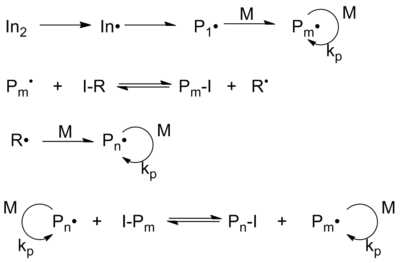
Die Iod-Transfer-Polymerisation (ITP) wurde von Tatemoto und Mitarbeitern in den 1970er Jahren entwickelt[10] und ergibt Fluorolefinpolymere. Während man der Reaktion im wissenschaftlichen Bereich wenig Aufmerksamkeit schenkt, ist diese Chemie die Basis für etliche industrielle Patente und Produkte und mag die kommerziell erfolgreichste Form der lebenden Radikalpolymerisation sein.[11] Sie wurde anfänglich verwendet, um Iod-Heilmittel in Fluorelastomere einzubringen.
Der Mechanismus der ITP erfordert eine thermale Zersetzung des Radikalstarters (typischerweise Persulfat), die das Anfangsradikal In• erzeugt. An dieses Radikal addiert sich das Monomer M und erzeugt so die Spezies P1•, was sich weiter fortpflanzen kann zu Pm•. Durch den Austausch des Iods vom Transferreagenz RI zum wandernden Radikal Pm• wird das neue Radikal R• gebildet und Pm• wird zum "schlafenden" Radikal. Diese Spezies kann mit dem Monomer M zu Pn• reagieren. Während der Polymerisation kommt es zum Austausch zwischen verschiedenen Polymerketten und ein Transferreagenz entsteht, was typisch ist für degenerative Transfersprozesse.
Typischerweise wird bei der Iod-Transfer-Polymerisation ein Mono- oder Diiod-Perfluoralkan als Startreagenz verwendet. Dieses Fluoralkane mag zum Teil mit Wasserstoff oder Chlor substituiert sein. Die Energie der Iod-Perfluoralkan-Bindung ist niedrig und, im Gegensatz zu Iod-Wasserstoff- Bindungen ist deren Polarisierung gering.[12]
Deswegen wird das Iod sehr einfach in Gegenwart von freien Radikalen abgespalten. Wenn man Iodperfluoralkane betrachtet, wird bei einer wachsenden Polyfluorolefinkette das Iod abgespalten und es kommt zum Abbruch der Kettenreaktion, wobei das neu gebildete Perfluoralkylradikal an ein weiteres Monomer anknüpft. Aber das Polyfluorolefin mit dem Iod-Ende agiert selbst als Kettentransfer-Reagenz. In einer RAFT-Reaktion ergibt sich, solange die Konzentration an Radikalstarter gering bleibt, als Produkt ein Polymer mit einer monodispersen statistischen Verteilung des Molekulargewichts.
Über konventionelle Kohlenwasserstofffmonomere mit einem Iodperfluoralkan als Kettentransferreagenz wurde schon berichtet.[13] Die resultierende statistische Verteilung des Molekulargewichts ist nicht besonders eng, da die Energien der Iod-Wasserstoff-Bindung sich ziemlich von der der Iod-Fluor-Kohlenstoff-Bindung unterscheidet, und die Entfernung eines Iod-Atoms vom Endpolymer entsprechend schwer ist. Außerdem wurde die Verwendung von Iod-Kohlenwasserstoffen beschrieben, aber wieder ergab sich keine enge Verteilung des Molekulargewichts.[14]
Außerdem wurde über die Darstellung von Block-Copolymeren unter Iod-Transfer-Polymerisation von Tatemoto et al. berichtet.[15]
Obwohl die Anwendung von lebenden Radikalreaktionsprozessen in Emulsionen als schwierig dargestellt wird,[16] wurden alle Beispiele von Iod-Transferpolymerisationen in Emulsionen durchgeführt. Man berichtet über extrem hohe Molekulargewichte.[17]
Unten sind noch andere Techniken der lebenden Radikalpolymersiation beschrieben, deren Bedeutung zunimmt.
Selen-zentrierte gesteuerte radikalische Polymerisation
Diphenyldiselenide und einige Benzylselenide wurden von Kwon et al. auf ihre Wirkung als Photoiniferter in Polymerisationen von Styrol und Methylmethacrylat überprüft. Der vorgeschlagene Mechanismus für diese Polymerisation ist ähnlich der des Dithiuam-Disulffid-Iniferters. Es erlauben niedrige Reaktionskontstanten eine Anwendung für die Block-Copolymer-Synthese, wobei man jedoch eine begrenzte Kontrolle über die statistische Verteilung des Molekulargewichts hat.[18]
Tellurid-gesteuerte Polymerisation
Tellurid-gesteuerte Polymerisation oder TERP schien zuerst nach einem reversiblen Kettentransfer-Mechanismus unter homolytischer Spaltung bei thermischen Reaktionsbedingungen zu verlaufen. Jedoch hat eine kinetische Studie gezeigt, dass TERP eher unter degenerativem Transfer als nach einem Dissoziation-Kombination-Mechanismus verläuft.[19]

Alkyltelluride der Struktur Z-X-R, wobei Z=Methyl und R=gute Abgangsgruppe mit freiem Radikal, ergeben besser kontrollierte Reaktionen für eine breite Auswahl an Monomeren, während bei Phenyltelluriden eine geringe kinetische Kontrolle vorhanden ist. Polymerisationen von Methylmethacrylaten laufen nur mit Ditelluriden kontrolliert ab. Die Wichtigkeit des X für den Kettentransfer steigt in der Serie O<S<Se<Te, was Alkyltelluride unter thermischer Initialisierung wirksam macht, um eine kontrollierte Reaktion durchzuführen, während für Alkylselenide und -sulfide eine photochemische Spaltung für den Radikalstart notwendig ist.
Stiban (Antimonwasserstoff) - gesteuerte Polymerisation
Yamago et al. berichteten über eine Stiban-gesteuerte Polymerisation, bei der man ein Organostiban-Transfer-Reagenz mit der generellen Struktur Z(Z')-Sb-R (wobei Z= aktivierende Gruppe und R= freies Radikal als Abgangsgruppe) verwendet. Eine große Bandbreite von Monomeren (Styrol, Acrylate, Vinyl …) kann kontrolliert reagieren, wobei sich eine enge statistische Verteilung des Molekulargewichts ergibt und vorhersagbares Molekulargewicht unter thermisch induzierten Reaktionsbedingungen. Yamago hat auch ein Patent publiziert, in dem er bewies, dass Bismuthalkyle kontrollierten radikalischen Polymerisationen mit ähnlichem Mechanismus unterliegen.[20][21]
Kupfer- gesteuerte Polymerisation
Darüber hinaus sind Radikalpolymerisationen mit reversibler Deaktivierung unter Kupfer-Katalyse bekannt.
Einzelnachweise
- ↑ a b c Jenkins AD, Jones RG, Moad G: Terminology for reversible-deactivation radical polymerization previously called "controlled" radical or "living" radical polymerization (IUPAC Recommendations 2010). In: Pure and Applied Chemistry. 82. Jahrgang, Nr. 2, 2009, ISSN 1365-3075, S. 483–491, doi:10.1351/PAC-REP-08-04-03.
- ↑ a b Szwarz, M.: 'Living' Polymers. In: Nature. 178. Jahrgang, Nr. 1, 1956, S. 1168–1169, doi:10.1038/1781168a0.
- ↑ a b Szwarz, M.: Comments on "Living Polymerization: Rationale for Uniform Terminology" by Darling et al. In: J. Polym. Sci. A. 38. Jahrgang, Nr. 10, 2000, S. 1710.
- ↑ Patent US4581429: Erfinder: D. H. Solomon, E. Rizzardo, P. Cacioli.
- ↑ G. Moad, E. Rizzardo: Alkoxyamine-Initiated Living Radical Polymerization: Factors Affecting Alkoxyamine Homolysis Rates. In: Macromolecules. 28. Jahrgang, Nr. 26, 1995, S. 8722–8728, doi:10.1021/MA00130A003.
- ↑ Zhong, M, Matyjaszewski, K: How Fast Can a CRP Be Conducted with Preserved Chain End Functionality? In: Macromolecules. 44. Jahrgang, Nr. 8, 2011, S. 2668–2677, doi:10.1021/ma102834s.
- ↑ Wang, Y, Soerensen, N, Zhong, M, Schroeder, H, Buback, Matyjaszewski, K: Improving the "Livingness" of ATRP by Reducing Cu Catalyst Concentration. In: Macromolecules. 46. Jahrgang, Nr. 3, 2013, S. 683–691, doi:10.1021/ma3024393.
- ↑ Role of initiator-transfer agent-terminator (iniferter) in radical polymerizations: Polymer design by organic disulfides as iniferters Die Makromolekulare Chemie, Rapid Communications Volume 3, Issue 2, Date: 16 February 1982, Pages: 127–132 doi:10.1002/marc.1982.030030208
- ↑ A model for living radical polymerization Die Makromolekulare Chemie, Rapid Communications Volume 3, Issue 2, Date: 16 February 1982, Pages: 133–140 Takayuki Otsu, Masatoshi Yoshida, Toshinori Tazaki doi:10.1002/marc.1982.030030209
- ↑ Tatemoto, Masayoshi; Suzuki, Takeshi; Tomoda, Masayasu; Furukawa, Yasuyoshi and Ueta, Yutaka (1981-01-06) "Cross linkable fluorine-containing polymer and its production" Patent US4243770.
- ↑ B Ameduri, B Boutevin: Use of telechelic fluorinated diiodides to obtain well-defined fluoropolymers. In: J. Fluorine Chem. 100. Jahrgang, 1999, S. 97–116, doi:10.1016/s0022-1139(99)00220-1.
- ↑ Carlson, Dana P. (1991-08-06) "Base resistant fluoroelastomers with improved processibility and curability". Patent US5037921.
- ↑ Arcella, Vincenzo; Brinati, Giulio; Albano, Margherita and Tortelli, Vito (1996-12-17) "Fluoroelastomers comprising monomeric units deriving from a bis-olefin". Patent US5585449.
- ↑ J. Banus, H. J. Emeleus, R. N. Haszeldine: 12. The heterolytic fission of the carbon?iodine bond in trifluoroiodomethane. In: J. Chem. Soc. 1951, S. 60, doi:10.1039/jr9510000060.
- ↑ M. Lansalot, C. Farcet, B. Charleux, J.-P. Vairon: Controlled Free-Radical Miniemulsion Polymerization of Styrene Using Degenerative Transfer. In: Macromolecules. 32. Jahrgang, Nr. 22, 1999, S. 7354–7360, doi:10.1021/ma990447w.
- ↑ K. Matyjaszewski, S. Gaynor, J.-S. Wang: Controlled Radical Polymerizations: The Use of Alkyl Iodides in Degenerative Transfer. In: Macromolecules. 28. Jahrgang, Nr. 6, 1995, S. 2093–2095, doi:10.1021/ma00110a050.
- ↑ K Ziegler: Die Bedeutung der alkalimetallorganischen Verbindungen für die Synthese. In: Angew. Chem. 49. Jahrgang, Nr. 30, 1936, S. 499–502, doi:10.1002/ange.19360493003.
- ↑ Tae Seok Kwon, Sadanori Kumazawa, Tetsuya Yokoi, Shuji Kondo, Hideo Kunisada, Yasuo Yuki: Living Radical Polymerization of Styrene with Diphenyl Diselenide as a Photoiniferter. Synthesis of Polystyrene with Carbon-Carbon Double Bonds at Both Chain Ends. In: Journal of Macromolecular Science, Part A. 34. Jahrgang, Nr. 9, 1997, S. 1553–1567, doi:10.1080/10601329708010026.
- ↑ Goto A, Kwak Y, Fukuda T, Yamago S, Iida K, Nakajima M, Yoshida J: Mechanism-based invention of high-speed living radical polymerization using organotellurium compounds and azo-initiators. In: J. Am. Chem. Soc. 125. Jahrgang, Nr. 29, 2003, S. 8720–1, doi:10.1021/ja035464m.
- ↑ Yamago S, Ray B, Iida K, Yoshida J, Tada T, Yoshizawa K, Kwak Y, Goto A, Fukuda T: Highly versatile organostibine mediators for living radical polymerization. In: J. Am. Chem. Soc. 126. Jahrgang, Nr. 43, 2004, S. 13908–9, doi:10.1021/ja044787v.
- ↑ Yamago S, Kayahara E, Kotani M, Ray B, Kwak Y, Goto A, Fukuda T: Highly controlled living radical polymerization through dual activation of organobismuthines. In: Angew. Chem. Int. Ed. Engl. 46. Jahrgang, Nr. 8, 2007, S. 1304–6, doi:10.1002/anie.200604473.


![{\displaystyle M_{\text{n}}=M_{\text{m}}\times {\frac {[{\text{M}}]_{0}-[{\text{M}}]_{t}}{[{\text{R-X}}]_{0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bafad896778ae585d925fb1cd6f62bc55cd633b6)