3-Methyloctano-1,4-lacton
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 3-Methyloctano-1,4-lacton | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C9H16O10 | ||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 156,22 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||
| Dichte |
0,952 g·cm−3[2] | ||||||||||||
| Siedepunkt | |||||||||||||
| Löslichkeit | |||||||||||||
| Brechungsindex |
1,4454 (20 °C)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
3-Methyloctano-1,4-lacton (auch Whiskylacton oder Quercuslacton, von lateinisch quercus „Eiche“) ist eine organische Verbindung aus der Gruppe der Lactone. Es handelt sich um ein Derivat des γ-Butyrolactons, bei dem der Ring zusätzlich mit einer Methylgruppe und einer Butylgruppe substituiert ist.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Ein cis-trans-Gemisch von 3-Methyloctano-1,4-lacton kann durch radikalische Additionsreaktion von Pentanal mit Crotonsäure und anschließende reduktive Cyclisierung der resultierenden γ-Oxosäure mit Natriumborhydrid/Schwefelsäure hergestellt werden.[3]
Isomerie
[Bearbeiten | Quelltext bearbeiten]3-Methyloctano-1,4-lacton kommt in den vier stereoisomeren Konfigurationen (3R,4R) bzw. (3S,4S) (beide Substituenten in cis-Stellung) und (3S,4R) bzw. (3R,4S) (beide Substituenten in trans-Stellung) vor, das heißt in Form von zwei Enantiomerenpaaren, die jeweils eine unterschiedliche optische Aktivität aufweisen (siehe unten in der Infobox).
Je nach Konfiguration haben die Verbindungen unterschiedliche sensorische Eigenschaften. Die beiden cis-Isomere weisen dabei eine zehnmal niedrigere Geruchsschwelle auf als die beiden trans-Isomere.[4]
| Stereoisomere | ||||
| Name | (3R,4R)-Quercuslacton (cis-Isomer) |
(3S,4S)-Quercuslacton (cis-Isomer) |
(3S,4R)-Quercuslacton (trans-Isomer) |
(3R,4S)-Quercuslacton (trans-Isomer) |
| Strukturformel | 
|

|
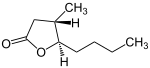
|

|
| CAS-Nummer | 55013-32-6 | 80041-00-5 | 80041-01-6 | 105119-22-0 |
| PubChem | 41285 | 11094871 | 11084123 | 11105597 |
| Wikidata | Q130360853 | Q27276558 | Q130360854 | Q7833482 |
| Beschreibung | farbloses Öl[5] | farbloses Öl[6] | farbloses Öl[7][6] | |
| Geruch[4] | starke Kokosnote, süßlich, frisch | schwache Kokosnote, erdig, holzartig, heuartig | schwache Kokosnote, schwache Sellerienote | starke Kokosnote |
| Geschmack[4] | schwache Kokosnote, cremig | an Kokosnuss erinnernd, krautartig | an Kokosnuss erinnernd, süß, cremig, fettig | schwach, krautartig |
| Siedepunkt | 124–124 °C (2266 Pa)[8] | 123–125 °C (2133 Pa)[8] | ||
| Brechungsindex | 1,4458 (23 °C)[8] | 1,4402 (23 °C)[8] | ||
| Löslichkeit | löslich in Methanol[5] | löslich in Methanol und Chloroform[6] | löslich in Methanol und Chloroform[7][6] | |
| Optische Aktivität | −76,9 (c = 1.73, Methanol, 24 °C, D)[5] | +81,2 (c = 1,24, Methanol, 20 °C, D)[6] | −82,5 (c = 1,02, Methanol, 20 °C, D)[6] | |
Vorkommen und Entstehung
[Bearbeiten | Quelltext bearbeiten]3-Methyloctano-1,4-lacton entsteht bei der Lagerung von Wein und Spirituosen in Eichenfässern aus Inhaltsstoffen des Eichenholzes [9] Im Whiskyaroma kommen nur die (3S,4S)- und (3S,4R)-Isomere vor.[10]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c George A. Burdock: Fenaroli's Handbook of Flavor Ingredients. CRC Press, 2016, ISBN 978-1-04-006994-3.
- ↑ a b c d e f Datenblatt Whiskey lactone, mixture of cis and trans, ≥98% bei Sigma-Aldrich, abgerufen am 26. September 2024 (PDF).
- ↑ Wiley-VCH: Ullmann's Food and Feed, 3 Volume Set. John Wiley & Sons, 2017, ISBN 978-3-527-33990-7, S. 1148.
- ↑ a b c Waldemar Ternes: Naturwissenschaftliche Grundlagen der Lebensmittelzubereitung. 3. Auflage. Behr’s Verlag, Hamburg 2008, S. 313–314, 316 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Minoru Ozeki, Daisuke Hashimoto, Kiyoharu Nishide, Tetsuya Kajimoto, Manabu Node: A concise synthetic route to optically active cis-β,γ-disubstituted-γ-butyrolactones via tandem Michael–MPV reaction: new total synthesis of (−)-cis-whisky lactone and (−)-cis-cognac lactone. In: Tetrahedron: Asymmetry. Band 16, Nr. 9, Mai 2005, S. 1663–1671, doi:10.1016/j.tetasy.2005.03.017.
- ↑ a b c d e f Xinpeng Jiang, Chunling Fu, Shengming Ma: A Concise Synthesis of (–)- and (+)- Whisky Lactones. In: European Journal of Organic Chemistry. Band 2010, Nr. 4, Februar 2010, S. 687–693, doi:10.1002/ejoc.200901058.
- ↑ a b Bin Mao, Koen Geurts, Martín Fañanás-Mastral, Anthoni W. van Zijl, Stephen P. Fletcher, Adriaan J. Minnaard, Ben L. Feringa: Catalytic Enantioselective Synthesis of Naturally Occurring Butenolides via -Allylic Alkylation and Ring Closing Metathesis. In: Organic Letters. Band 13, Nr. 5, 4. März 2011, S. 948–951, doi:10.1021/ol102994q.
- ↑ a b c d T. EBATA, K. MATSUMOTO, H. YOSHIKOSHI, K. KOSEKI, H. KAWAKAMI, K. OKANO, H. MATSUSHITA: ChemInform Abstract: Synthesis of (+)-trans-Whisky Lactone (I), (–)-cis-Whisky Lactone (II), (+)-Cognac Lactone (III), and (+)-Eldanolide (IV). In: ChemInform. Band 24, Nr. 31, 3. August 1993, S. no–no, doi:10.1002/chin.199331159.
- ↑ Erwan Guichoux: Prédiction de la qualité des bois de chêne pour l’élevage des vins et des alcools : comparaison des approches physicochimiques, sensorielles et moléculaires. (PDF; 6,3 MB) Thèse présentée à Université de Bordeaux I. Ecole Doctorale Sciences et Environnements, 6. April 2011, S. 222, abgerufen am 22. April 2012.
- ↑ H.-D. Belitz u. a.: Lehrbuch der Lebensmittelchemie. 6. Auflage. Springer, Berlin u. Heidelberg 2008, S. 964 (eingeschränkte Vorschau in der Google-Buchsuche).
Literatur
[Bearbeiten | Quelltext bearbeiten]- A. J. Buglass (Hrsg.): Handbook of alcoholic beverages. Bd. 1. Wiley, Chichester 2011, S. 523–524 (eingeschränkte Vorschau in der Google-Buchsuche).
- Charakterisierung der Whiskylaktone im Holz rheinland-pfälzischer Eichen. (PDF; 104 kB)
