Chloridkanal
| Chloridkanal | ||
|---|---|---|
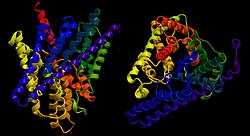
| ||
| Bändermodell des ClC von E. coli von der Seite und oben, nach PDB 3NMO | ||
| Bezeichner | ||
| Gen-Name(n) | CLCN1, CLCN2, CLCN3, CLCN4, CLCN5, CLCN6, CLCN7 | |
| Transporter-Klassifikation | ||
| TCDB | 2.A.49 | |
| Bezeichnung | Chloridkanäle | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
| Ausnahmen | mehrere Protozoen mit kleinem Genom | |
Als Chloridkanäle werden in der Physiologie und Zellbiologie Ionenkanäle bezeichnet, die eine spezifische und mehr oder weniger selektive Leitfähigkeit für Chlorid-Ionen aufweisen. Chloridkanäle sind molekular sehr divers und werden von mehreren Genfamilien oder einzelnen Genen kodiert. Die CLCN Genfamilie kodiert für 4 verschiedene Chloridkanäle und 5 verschiedene Chlorid-Protonen-Austauscher, die TMEM16 (oder auch Anoctamin) Genfamilie für Ca-aktivierte Chloridkanäle, aber auch für weniger spezifische Kanäle und Lipidtransporter, die LRRC8 Genfamilie für 5 verschiedene Untereinheiten des Volumen-regulierten Anionenkanals VRAC, und Bestrophine für mehrere, oft Ca-aktivierte Cl Kanäle. CFTR (Cystic Firbrosis Transmembrane Conductance Regulator) ist ein cAMP-aktivierter Chloridkanal und ASOR/TMEM206 ein säureaktivierter Chloridkanal. Die inhibitorischen GABA-A und Glyzin-Rezeptoren sind ebenfalls Chloridkanäle.
Die CLC (abgeleitet vom englischen chloride channel) Familie umfasst Chloridkanäle, aber auch sekundär aktive Chlorid/Protonen-Austauscher (Transporter). Strukturelle Homologe dieser Familie finden sich durch alle biologischen Reiche hinweg, vom einfachen Darmbakterium Escherichia coli über Pflanzen bis hin zu den Säugetieren. Hierbei übernehmen die Kanäle unterschiedliche biologische Funktionen, wie z. B. die Teilhabe an der Regulation des zellulären Wasserhaushaltes oder die Stabilisierung des Ruhemembranpotentials im Skelettmuskel.
Wissenschaftliche Historie
[Bearbeiten | Quelltext bearbeiten]Chloridkanäle und -Leitfähigkeiten waren schon Jahrzehnte vor der molekularen Identifizierung aus physiologischen Studien bekannt.[1] 1980 entdeckten Miller und Kollegen[2] einen zunächst merkwürdig erscheinenden Chloridkanal in Vesikeln des elektrischen Organs des Torpedorochens. Anhand von Einzelkanal-Untersuchungen sagte er einen doppelporigen Kanal voraus, was später nach der Klonierung von vielen Untersuchungen bestätigt wurde. 1990 gelang Thomas Jentsch die Klonierung des Torpedo Kanals, den er ClC-0 nannte.[3] Dies öffnete die Tür zur Identifizierung der CLCN Genfamilie und zur Untersuchungen der Struktur, Funktion und Rolle in verschiedenen Pathologien.[4] So konnten u. a. Jentsch und Mitarbeiter zeigen, dass Mutationen in menschlichen CLCN Genen zu Krankheiten wie Myotonie, Nierensteinen, schweren Salzverlust über die Niere, Taubheit und Blindheit, Neurodegeneration und Bluthochdruck führen. Diese Pathologien wurden bis dahin nicht mit Chloridtransport assoziiert. 2002 löste R. Dutzler röntgenkristallographisch (2.5–3.5 Å) die Strukturen der ClC-Transporter EcClC und StClC von E. coli bzw. Salmonella typhi und schuf damit die Basis für detaillierte Struktur-Funktions Untersuchungen.[5]
Isoformen im Menschen
[Bearbeiten | Quelltext bearbeiten]Im Menschen finden sich neun Isoformen der CLC-Familie. Einige davon werden in den Plasmamembranen exprimiert, andere (ClC-3 bis ClC-7) in Membranen von intrazellulären Organellen. ClC-1 zum Beispiel findet sich in der Plasmamembran von Zellen des Skelettmuskels und ist in der Einstellung des Ruhemembranpotentials involviert.
Die einzelnen humanen Chlorid-Transporter: ClC-1, ClC-2, ClC-Ka, ClC-Kb, ClC-3, ClC-4, ClC-5, ClC-6, ClC-7. Manche dieser Kanäle und Transporter benötigen akzessorische Untereinheiten, z. B. ClC-Ka und ClC-Kb barttin[6], und ClC-7 Ostm1[7].
Chloridkanäle in Pflanzen
[Bearbeiten | Quelltext bearbeiten]Chloridkanäle erfüllen verschiedene Funktionen in Pflanzen, abhängig von ihrer Lokalisierung und ihrer Ionenaffinität. Am besten untersucht sind die sieben Chloridkanäle von Arabidopsis thaliana, AtCLCa bis AtCLCg.[8][9] Die Kanäle befinden sich in den Membranen verschiedener Organelle und erfüllen dort die Funktion von Aniontransportern. So transportieren AtCLCa und AtCLCe Nitrat anstelle von Chlorid über Membranen.[10]
Die Struktur
[Bearbeiten | Quelltext bearbeiten]CLC-Transporter und -Kanäle sind rautenförmige Homodimere. Jede Untereinheit besitzt eine eigene sanduhrenförmige Pore mit der engsten Stelle im Zentrum der Membran. Von der extra- und intrazellulären Seite reichen zwei ausgedehnte wassergefüllte Vorhöfe in die Pore hinein, zentral liegt die Pore wasserfrei vor. Es werden drei Ionenbindungsstellen angenommen: zwei je an der Kontaktfläche zwischen Vorhof und Poreninnerem und eine im wasserfreien Zentrum. Koordiniert werden die Ionen bei der Permeation hierbei von partiell geladenen Seitenketten-Hydroxygruppen und einigen Hauptkettenstickstoffatomen, welche gemeinsam den Selektivitätsfilter bilden und die Ionen energetisch durch den hydrophoben Teil der Membran balancieren.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Andere Ionenkanäle: Natriumkanal – Kaliumkanal – Calciumkanal
- Mukoviszidose (eine Erkrankung bei verändertem Chloridkanal)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ J. W. Woodbury, P. R. Miles: Anion conductance of frog muscle membranes: one channel, two kinds of pH dependence. In: The Journal of General Physiology. Band 62, Nr. 3, September 1973, ISSN 0022-1295, S. 324–353, doi:10.1085/jgp.62.3.324, PMID 4542368, PMC 2226118 (freier Volltext).
- ↑ Christopher Miller, Michael M. White: A VOLTAGE-DEPENDENT CHLORIDE CONDUCTANCE CHANNEL FROM TORPEDO ELECTROPLAX MEMBRANE. In: Annals of the New York Academy of Sciences. Band 341, 1 Anion and Pro, Mai 1980, ISSN 0077-8923, S. 534–551, doi:10.1111/j.1749-6632.1980.tb47197.x (wiley.com [abgerufen am 28. Februar 2023]).
- ↑ Thomas J. Jentsch, Klaus Steinmeyer, Gisela Schwarz: Primary structure of Torpedo marmorata chloride channel isolated by expression cloning in Xenopus oocytes. In: Nature. Band 348, Nr. 6301, Dezember 1990, ISSN 0028-0836, S. 510–514, doi:10.1038/348510a0 (nature.com [abgerufen am 28. Februar 2023]).
- ↑ Thomas J. Jentsch: Discovery of CLC transport proteins: cloning, structure, function and pathophysiology: Discovery of CLC transport proteins. In: The Journal of Physiology. Band 593, Nr. 18, 15. September 2015, S. 4091–4109, doi:10.1113/JP270043, PMID 25590607, PMC 4594286 (freier Volltext) – (wiley.com [abgerufen am 28. Februar 2023]).
- ↑ R. Dutzler, E. B. Campbell, M. Cadene, B. T. Chait, R. MacKinnon: X-ray structure of a ClC chloride channel at 3.0 A reveals the molecular basis of anion selectivity. In: Nature. 415(6869), 17. Jan 2002, S. 276–277. PMID 11796999
- ↑ Raúl Estévez, Thomas Boettger, Valentin Stein, Ralf Birkenhäger, Edgar Otto, Friedhelm Hildebrandt, Thomas J. Jentsch: Barttin is a Cl- channel β-subunit crucial for renal Cl- reabsorption and inner ear K+ secretion. In: Nature. Band 414, Nr. 6863, 29. November 2001, ISSN 0028-0836, S. 558–561, doi:10.1038/35107099 (nature.com [abgerufen am 28. Februar 2023]).
- ↑ Philipp F. Lange, Lena Wartosch, Thomas J. Jentsch, Jens C. Fuhrmann: ClC-7 requires Ostm1 as a β-subunit to support bone resorption and lysosomal function. In: Nature. Band 440, Nr. 7081, März 2006, ISSN 0028-0836, S. 220–223, doi:10.1038/nature04535 (nature.com [abgerufen am 28. Februar 2023]).
- ↑ M. Hechenberger, B. Schwappach, W. N. Fischer, W. B. Frommer, T. J. Jentsch, K. Steinmeyer: A family of putative chloride channels from Arabidopsis and functional complementation of a yeast strain with a CLC gene disruption. In: The Journal of Biological Chemistry. Band 271, Nr. 52, 27. Dezember 1996, ISSN 0021-9258, S. 33632–33638, doi:10.1074/jbc.271.52.33632, PMID 8969232.
- ↑ Cloning and molecular analyses of the Arabidopsis thaliana chloride channel gene family. In: Plant Science. 2009, doi:10.1016/j.plantsci.2009.02.006.
- ↑ Two anion transporters AtClCa and AtClCe fulfil interconnecting but not redundant roles in nitrate assimilation pathways. In: New Phytologist. 2009; doi:10.1111/j.1469-8137.2009.02837.x.
Literatur
[Bearbeiten | Quelltext bearbeiten]- T. J. Jentsch, V. Stein, F. Weinreich, A. A. Zdebik: Molecular structure and physiological function of chloride channels. In: Physiol Rev. 82(2), Apr 2002, S. 503–568. Review. PMID 11917096
Weblinks
[Bearbeiten | Quelltext bearbeiten]- PROSITE documentation PDOC51371. CBS-Domäne. Swiss Institute of Bioinformatics (SIB), abgerufen am 20. September 2011 (englisch).
