Auxine
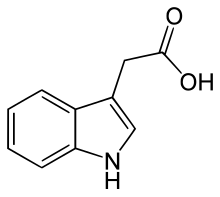

Die Auxine (altgr. αὐξάνω auxánō „ich wachse“) sind eine Gruppe von Wachstumsregulatoren. Sie wirken auf Wachstums- und Differenzierungsprozesse bei Gefäßpflanzen und im Protonema der Laubmoose. Die natürlich vorkommenden pflanzlichen Auxine gehören zu den Phytohormonen, die synthetischen werden in der Landwirtschaft eingesetzt.
Gegenspieler der Auxine sind die Blastokoline. Die Auxine sind in der Fachsprache aufgrund ihrer Wirkung auch unter dem Namen Streckungshormone bekannt. In Pflanzen sind sie essentiell.
Ihre Rolle als Pflanzenhormone entdeckte in den 1920er Jahren Frits Warmolt Went. Das Auxin Indol-3-essigsäure isolierte Kenneth V. Thimann (und unabhängig Fritz Kögl und Kollegen).
Struktur
[Bearbeiten | Quelltext bearbeiten]Die molekulare Struktur der verschiedenen Auxine ist recht unterschiedlich. Allen gemeinsam ist ein planares aromatisches Ringsystem und ein Rest mit hydrophober Übergangsregion und terminaler Carboxygruppe (–COOH). Der Aromat kann allerdings recht unterschiedliche Strukturen aufweisen. Wirksam sind Indole aber auch Phenyle sowie ein Naphthylrest. Außerdem variiert die Länge der hydrophoben Übergangsregion (ein bis drei CH2-Gruppen).
Natürliche Auxine
[Bearbeiten | Quelltext bearbeiten]Indol-3-essigsäure (IAA, β-Indolylessigsäure, Heteroauxin) ist der wichtigste Vertreter der Auxine. Sie kommt in allen höheren Pflanzen in geringer Menge (1 bis 100 µg je kg Pflanzenmaterial) vor und ist auch in niederen Pflanzen und Bakterien vertreten. Sie ist das stärkste und häufigste Auxin und somit für den Großteil der natürlichen Auxineffekte verantwortlich. Kommerziell wird IAA jedoch nicht verwendet, da sie in wässriger Lösung verhältnismäßig instabil ist.
Indol-3-essigsäure findet man im Pflanzengewebe entweder in freier Form und über die Carboxygruppe esterartig an myo-Inosit, Glucose oder Galactose oder peptidartig an Aminosäuren, wie Asparaginsäure oder Tryptophan, gebunden vor. Diese Indol-3-essigsäurederivate werden als Auxinkonjugate bezeichnet und als Glykosyl, myo-Inosityl- bzw. Peptidylkonjugate unterschieden. Auxinkonjugate sind alle biologisch inaktiv. Sie spielen bei der Regulation des Auxinstoffwechsels eine wichtige Rolle. In verschiedenen Pflanzen finden sich weitere strukturverwandte Verbindungen der Indol-3-essigsäure wie zum Beispiel 4-Chlorindolylessigsäure, Indolylethanol, Indolylacetamid, Indolylacetonitril und Indolylacetaldehyd. Diese dienen zum Teil als Biosynthesevorstufen (Auxinvorstufen).
Weitere natürliche Auxine sind Phenylessigsäure (PAA), 4-Chloroindol-3-essigsäure (4-Cl-IAA) und 4-(Indol-3-yl)buttersäure (IBA). IBA wurde lange als rein synthetisches Auxin betrachtet, mittlerweile jedoch auch aus Mais und anderen Pflanzen (zum Beispiel Senfpflanzen) isoliert.
Synthetische Auxine
[Bearbeiten | Quelltext bearbeiten]Von den synthetischen Verbindungen mit Auxinaktivität sind vor allem 4-(Indol-3-yl)buttersäure (β-Indolylbuttersäure, IBA) und Indolylpropionsäure, Phenyl- und 1-Naphthylessigsäure sowie Phenoxy- und Naphthoxyessigsäuren von praktischer Bedeutung. Außerdem gibt es noch 2,4-Dichlorphenoxyessigsäure und Dicamba.
Sie werden künstlich im Labor hergestellt. Dabei wird eine alkoholische Lösung (im %-Bereich) unter eine Trägersubstanz (Talkum oder Aktivkohle) gerührt. Nach dem Trocknen entsteht ein Staub, in den zum Beispiel die Stecklingsbasen eingetaucht werden können. Seltener wird die Lösung direkt auf die Pflanzen versprüht. Ebenfalls selten wird der Wuchsstoff direkt ins Gießwasser gegeben.
Kommerziell angebotene Produkte sind zum Beispiel: PhytoBoost® (Wirkstoffe: Indol-3-essigsäure, Vitamine) als einziges Produkt mit dem natürlichen Auxin IAA, ferner SuperThrive® (Wirkstoffe: 1-Naphthylessigsäure und viele andere, nicht veröffentlichte Bestandteile), Seradix® (Wirkstoff: 4-(Indol-3-yl)buttersäure), das in drei verschiedenen Konzentrationen erhältlich ist (0,2 %, 0,4 % und 0,8 %) oder Rhizopon®/Chryzopon® (Wirkstoffe: 4-(Indol-3-yl)buttersäure oder Naphthylessigsäure in verschiedenen Konzentrationen).
Biosynthese
[Bearbeiten | Quelltext bearbeiten]
Die Bildung von Indol-3-essigsäure (IAA) erfolgt in jungen, sich schnell teilenden und wachsenden Geweben, insbesondere im Spross, Koleoptil und in Sprossspitzen, jungen Blättern, sich entwickelnden Samen und dem aktiven Kambium. Auch im apikalen Wurzelmeristem wird IAA gebildet. IAA ist mit Tryptophan (Trp) strukturell verwandt. In der Tat gibt es einen Tryptophan-abhängigen und einen Trp-unabhängigen Syntheseweg, bei dem die Biosynthese aus einer Tryptophanvorstufe erfolgt.
Beim Tryptophan-abhängigen Weg sind insgesamt vier Stoffwechselwege bekannt, deren Endprodukt IAA ist. Es sind der Tryptamin-Weg (TAM), der Indol-3-pyruvat-Weg (IPA), der Indol-3-acetonitril-Weg (IAN) und ein Stoffwechselweg, der nur in Bakterien (A. tumefaciens) vorkommt.[1] In Pflanzen sind die ersten beiden Wege am weitesten verbreitet. Die Entdeckung von Mutanten, welche Tryptophan nicht selbst herstellen konnten, aber dennoch IAA enthielten, warf Fragen nach einem Tryptophan-unabhängigen Syntheseweg auf. Diese Mutante waren überdies auch nicht in der Lage, durch im Überschuss verabreichtes Trp aus diesem Auxin herzustellen. Man hat durch isotopenmarkierte Fütterungsversuche festgestellt, dass der Tryptophanvorläufer Indol-3-glycerinphosphat als Vorläufer der Auxinsynthese dient. Genauere Untersuchungen ergaben aber, dass es sich bei der IAA-Bildung um eine chemische Zersetzung von Indol-3-glycerinphosphat handelt, welche nicht von Enzymen katalysiert wird.
Transport
[Bearbeiten | Quelltext bearbeiten]Der Transport von Auxin erfolgt überwiegend vom Spross zur Wurzelspitze. Die Inaktivierung der Auxine geschieht durch enzymatisch katalysierten oxidativen Abbau oder durch Konjugatbildung zur Speicherung.
Auxin ist das einzige polar transportierte Phytohormon. Der Transport erfolgt entweder parenchymatisch oder über die Leitgefäße (im Spross basipetal, in der Wurzel akropetal bzw. über kurze Strecken auch basipetal). Für den Transport im Phloem ist eine chemische Modifikation notwendig. Hierbei findet eine kovalente Bindung mit Glucose, myo-Inositol oder Aspartat statt. Diese IAA-Konjugate sind physiologisch inaktiv und es erfolgt am Zielgewebe eine Spaltung der kovalenten Bindung.
Den Transport kann man in zwei Gruppen unterteilen:
- über längere Strecken: im Phloem, vorwiegend basipetal, etwa 10 bis 20 cm/h
- über kürzere Strecken: polarer Transport von Zelle zu Zelle im Parenchym, ebenfalls basipetal mit Hilfe zweier Anionen-Transporter, einem Auxin-Influx-Carrier (zum Beispiel AUX1 in Arabidopsis) und einem Auxin-Efflux-Carrier (PIN Proteine).[2][3] Influx-Carrier befinden sich vor allem in der apikalen Zellmembran einer Zelle, während die Efflux-Carrier entgegengesetzt in der basalen Membran vorkommen. AUX1 funktioniert als Protonen-Symporter (sekundär aktiver Transport), d. h. deprotoniertes Auxin (anionische Form) wird zusammen mit zwei Protonen in die Zelle hinein transportiert. Außerdem kann Auxin durch den niedrigen pH-Wert (etwa 5,5) in der Zellwand in protonierter Form durch die Membran diffundieren. Durch den neutralen pH (etwa 7,0) in der Zelle deprotoniert Auxin und kann nicht mehr einfach durch die Membran aus der Zelle diffundieren. Es wird durch PIN-Proteine am basalen Ende der Zelle wieder aktiv aus der Zelle heraus geschleust. Derselbe Vorgang wiederholt sich in der nächst unteren Zelle, und so kommt ein polarer Transport mit einer Geschwindigkeit von etwa 1 cm/h zustande.
In Arabidopsis gibt es eine ganze Genfamilie von AtPIN-Proteinen. Ihr Name leitet sich von Arabidopsis thaliana und dem blattlosen (englisch pin – Nadel) Phänotyp entsprechender Mutanten ab und sie sind mittlerweile recht gut untersucht. Der gerichtete Transport von Zelle zu Zelle kann durch veränderte Expression der PIN-Carrier modifiziert werden. Dadurch kann der IAA-Strom in der Pflanze umgelenkt werden. Auf diesem Effekt beruhen zum Beispiel der Phototropismus und der Gravitropismus.
Wirkung
[Bearbeiten | Quelltext bearbeiten]
Auxine haben eine vielfältige, allgemein fördernde Wirkung auf die Gesamtentwicklung von höheren Pflanzenarten im komplexen Zusammenspiel mit anderen Phytohormonen. Auxine wirken besonders auf die Zellstreckung, vor allem von Koleoptilen und in den Sprossachsen. Dies ist der klassische Auxineffekt. Sie regen die Kambiumtätigkeit an, beeinflussen Zellteilung, Apikaldominanz, Abszission, Phototropismus und Gravitropismus und andere Wachstums- und Entwicklungsprozesse.
Die kontrovers diskutierte Pflanzenneurobiologie schreibt Auxin darüber hinaus eine neurotransmitterartige Wirkung zu.[4]
Konzentrationsabhängige Wirkung
[Bearbeiten | Quelltext bearbeiten]In hohen Dosen wirken Auxine überraschenderweise stark wachstumshemmend. Der Grund hierfür liegt in organspezifischen Konzentrationsoptima. Dabei wirken geringere Dosen des Hormons bis zu einer gewissen Konzentration fördernd auf das Zellstreckungswachstum, während zu hohe Konzentrationen das Streckungswachstum hemmen. Bei einer zu hohen Konzentration von Indol-3-essigsäure wird die Synthese von gasförmigem Ethylen gefördert, einem Stress-„Hormon“, welches sich beispielsweise negativ auf das Längenwachstum der Wurzeln auswirkt.[5] In der Sprossachse liegt die optimale Konzentration in der Regel höher als in der Wurzel, weshalb es dort schon bei geringeren Auxinkonzentrationen zur Wachstumshemmung kommt. Dies spielt möglicherweise beim Gravitropismus eine wichtige Rolle.
Die Auxinwirkung wird bei Wuchsstoffherbiziden (zum Beispiel 2,4-Dichlorphenoxyessigsäure oder kurz 2,4-D, und 2,4,5-Trichlorphenoxyessigsäure oder kurz 2,4,5-T) genutzt. Das Herbizid 2,4-D wirkt selektiv auf dikotyle Unkräuter, indem es diese zu übermäßigem Wachstum anregt und so deren Biosynthesekapazität erschöpft. Monokotyle Pflanzen (wie beispielsweise die Getreidepflanzen) reagieren nicht auf 2,4-D.
Physiologische Wirkung
[Bearbeiten | Quelltext bearbeiten]Streckungswachstum
[Bearbeiten | Quelltext bearbeiten]Die hauptsächliche Wirkung von Auxin ist die Förderung des zellulären Streckungswachstums. Das beruht auf zwei Effekten:
- Säurewachstum: Die Säurewachstumstheorie (englisch acid growth theory) wurde schon 1971 von Hager entdeckt und vielfach bestätigt. IAA bewirkt die Aktivierung membranständiger H+-ATPasen sowie die Induktion ihrer Neusynthese und den Export ihrer Bausteine in die Zellmembran. Dort bewirken sie durch Ausschleusen von Protonen eine Ansäuerung der Zellwand. Dadurch werden unter Mithilfe von Expansinen Wasserstoffbrückenbindungen zwischen Zellwandfasern, nämlich den Xyloglucane und Cellulosemikrofibrillen gespalten. Dadurch wird der Zellwanddruck vermindert und das Wasserpotential in der Zelle sinkt, dadurch kommt es zu einem Wassereinstrom in die Zelle und somit in die Vakuolen. Durch die nun herrschende Druckspannung der Zellen weitet sich die Zellwand (vor allem quer zur Richtung der Fibrillen) und es kommt zur Zellstreckung. An dieser Auxin-Wirkung ist wahrscheinlich das Auxinbindeprotein 1 (ABP1; siehe unten) beteiligt.
- Zellwandsynthese: Neben dem eigentlichen Streckungsvorgang induziert IAA auch die Neubildung von Zellwandbausteinen und damit die Erweiterung der Zellwand parallel zum Streckungswachstum. Diese Auxin-Wirkung erfolgt über direkte Geninduktion (siehe unten).
Dadurch, dass der Transport von Auxin gerichtet stattfindet, erfolgt auch die Zellstreckung nach einem entsprechenden Muster. Darauf beruhen mehrere Auxinwirkungen:
- Phototropismus: Pflanzen können die Lichtverhältnisse ihrer Umgebung durch sogenannte Photorezeptoren wahrnehmen und ihr Wachstum sowie ihre Entwicklung darauf ausrichten. Das Wachstum zum Licht hin wird als Phototropismus bezeichnet. In höheren Pflanzen sind die entsprechenden Photorezeptoren Phototropine. Bei ungleicher Belichtung des Sprosses kommt es unter anderem zum Ausfall von PIN-Proteinen auf der Lichtseite. Dadurch wird der Auxin-Strom in der Pflanze auf die Schattenseite umgelenkt. Dort erfolgt verstärke Zellstreckung, so dass sich die Pflanze zum Licht krümmt. Man sagt, das Sprosswachstum erfolgt positiv phototrop.
- Gravitropismus: Durch bestimmte Sensorsysteme (diskutiert werden vor allem Amyloplasten und Golgi-Vesikel) in der Wurzel kann die Schwerkraft wahrgenommen werden. Kippt man eine Pflanze zur Seite, so wird der Auxin-Strom durch PIN-Verlagerung auf die Unterseite der Wurzel umgeleitet. Durch die hohe Auxin-Empfindlichkeit der Wurzel wirkt dieser Auxin-Strom hemmend auf die Zellstreckung der Unterseite, so dass die Wurzel sich nach unten krümmt. Das Wachstum erfolgt in der Wurzel also positiv gravitrop. Umgekehrt lässt sich beobachten, dass der Spross der Pflanze sich nach dem Kippen nach oben krümmt; das Sprosswachstum ist also negativ gravitrop.
Dies beruht wahrscheinlich auf dem oben erwähnten höheren Konzentrationsoptimum von Auxin im Spross, welches hier eine fördernde Wirkung auf die Zellteilung hat.
Apikale Dominanz
[Bearbeiten | Quelltext bearbeiten]Eine weitere wichtige Wirkung von Auxin ist die Apikaldominanz, die zum Beispiel während der Schattenflucht stärker ausgeprägt ist. Dabei hemmt in der Sprosspitze gebildetes Auxin das Austreiben von lateralen Seitenknospen. Gegenspieler ist hier Cytokinin, welches das Austreiben von Seitenknospen (zum Beispiel nach Entfernen der Sprossspitze) fördert. Der genaue Mechanismus der Apikaldominanz ist jedoch noch umstritten. Ein Einfluss der auxinbedingten Induktion der Ethylenbiosynthese wird diskutiert.
Zellteilung und Differenzierung
[Bearbeiten | Quelltext bearbeiten]Zusammen mit dem Phytohormon Cytokinin fördert Auxin auch das Teilungswachstum und die Differenzierung von Zellen.
- Zellteilung: Die Zellteilung wird durch Regulation des Zellzyklus gesteuert. Auxine, Cytokinine, Gibberelline und Brassinosteroide wirken fördernd, Abscisinsäure und Jasmonsäure hemmend. Die Wirkung der fördernden Phytohormone beruht auf der Genaktivierung von Cyclinen und cyclin-abhängigen Kinasen (CDKs).
Speziell handelt es sich um Cyclin D sowie CDK A für den Übergang von der G1- in die S-Phase und die Cycline A und B sowie CDK A und B für den Übergang von der G2- in die M-Phase.
- Zelldifferenzierung: Für die Differenzierung ist das Mengenverhältnis von Auxin zu Cytokinin entscheidend. Bei einem hohen Auxin:Cytokinin-Verhältnis bildet sich Wurzelgewebe, bei einem niedrigen Auxin:Cytokinin-Verhältnis bildet sich ein Spross. Diese Wirkung wird zum Beispiel zur Organogenese in der Pflanzlichen Gewebekultur ausgenutzt. In der Pflanze kommt es bei hoher Auxinkonzentration zu vermehrter Bildung von Adventiv- und Seitenwurzeln. Außerdem wird im Kambium bei einem Auxin-Cytokinin-Verhältnis von ungefähr 1:1 Xylemgewebe gebildet. Das spielt vor allem in der Pflanzenentwicklung und nach Verwundung eine Rolle.
Auxin steuert auch die Fruchtbildung und -entwicklung. Nach der Bestäubung regt IAA aus dem Pollen die Zellteilungen für den Fruchtansatz an, das spätere Streckungswachstum im Fruchtgewebe wird von IAA aus den sich entwickelnden Samen ausgelöst. Äußerlich zugeführtes Auxin führt bei vielen Pflanzen zur Parthenokarpie, was zum Beispiel in der Agrikultur genutzt wird um die Fruchtbildung zu synchronisieren oder zum Beispiel kernlose Früchte wie Tomaten, Gurken etc. zu erzielen. Im Embryo führt der Konzentrationsgradient von Auxin zur Musterbildung und bestimmt damit welcher Teil sich zu Wurzel, Spross und Kotyledonen entwickelt.
Im Protonema der Laubmoose, wie zum Beispiel Physcomitrella patens, induzieren Auxine spezifisch den Übergang von Chloronema zu Caulonema. Damit geht eine Änderung in der Zellzykluskontrolle einher.[6]
Seneszenz
[Bearbeiten | Quelltext bearbeiten]Auxin verzögert die Seneszenz und verhindert den Abwurf von Blättern, Blüten und Früchten, indem es die Ausbildung von Trenngeweben hemmt. Gegenspieler sind Abscisinsäure und vor allem Ethylen. Höhere Konzentrationen von IAA fördern allerdings die Ethylenbiosynthese.
Molekulare Wirkung
[Bearbeiten | Quelltext bearbeiten]Die molekulare Wirkung von Auxin ist noch nicht vollständig verstanden. Als erstes wurde in den 1980er Jahren ein Auxinrezeptor mit dem sogenannten Auxinbindeprotein 1 (ABP1) entdeckt, welches Auxine spezifisch bindet. ABP1 interagiert mit einem noch nicht identifizierten Dockingprotein an der Plasmamembran. Die Weiterleitung des Signals ist unbekannt, bewirkt jedoch die Modulation von Membrantransportproteinen (insbesondere der Protonenpumpe). Für die Auxin-induzierte Veränderung der Expression bestimmter auxininduzierter Gene wurde ABP1 jedoch verworfen.
Die auxininduzierte Genexpression lässt sich in eine schnelle, direkte und eine etwas langsamere, indirekte Wirkung unterteilen. An der direkten Genexpression sind unter anderem sogenannte „auxin response factors“ (ARFs) beteiligt, die an „auxin response elements“ (Aux-Res; Sequenz TGTCTC) der DNA binden und die Genexpression kontrollieren. Dabei bewirkt Auxin im Grunde genommen die Aufhebung einer Gen-Hemmung. Das ist auch der Grund für die schnelle Wirkung. Im Normalzustand auxinregulierter Gene ist ARF zusammen mit einem Repressor („AUX/IAA“) als Heterodimer an das AUX-Res gebunden. Das Gen wird nicht exprimiert. Wenn Auxin hinzukommt bindet und aktiviert es den sogenannten „SCF-Komplex“, eine Ubiquitin-Protein-Ligase (mit TIR1), die den Repressor ubiquitiniert und damit zum Abbau markiert. Der Repressor wird vom Proteasom abgebaut, und das Gen kann transkribiert werden. So werden beispielsweise Zellwandbausteine für die Zellstreckung gebildet. Viele direkt auxin-gesteuerte Gene entstammen unter anderem aus den Genfamilien AUX/IAA, SAUR (Small Auxin Up RNAs) und GH3. Ein Kaliumkanal (ZMK1) konnte kürzlich als wachstumsrelevantes auxininduziertes Protein identifiziert werden. Die indirekte Genexpression erfolgt über die gerade beschriebene direkte Induktion von Transkriptionsfaktoren. Diese ermöglichen ihrerseits die Expression von weiteren Genen.
Inhibierung des Auxin-abhängigen Wachstums
[Bearbeiten | Quelltext bearbeiten]Die Mechanismen hinter Photo- und Gravitropismus sind Gegenstand der aktuellen Forschung. Seit einigen Jahren wird vermutet, dass nicht nur die Auxinwirkung allein an der Krümmung der Sprossachsen, wie sie z. B. beim Phototropismus auftritt, verantwortlich ist. Chemische Verbindungen, sogenannte Sesquiterpenlactone, beeinflussen höchstwahrscheinlich physiologische Prozesse in den Pflanzengeweben und wirken als Inhibitoren des Auxin-abhängigen Streckungswachstums. Früher wurde angenommen, dass ein Auxin-Gradient in der Sprossachse für das differenzielle Streckungswachstum der Zellen verantwortlich ist. Heute nimmt man an, dass ein Gradient von Sesquiterpenlactonen, der den polaren Auxintransport inhibiert, einen wesentlichen Teil dazu beiträgt.[7][8] Diese These u. a. durch Versuche gestützt, bei denen erkannt wurde, dass bei einer einseitigen Belichtung von Sonnenblumen Hypokotylen keine differenzielle Verteilung von Auxin geschieht.[9] Daraus wurde gefolgert, dass Auxininhibitoren auf der belichteten Seite der Pflanze für die Krümmungsreaktion in der Sprossachse verantwortlich sein müssten. Außerdem wurde eine abwärts gerichtete Diffusion der Sesquiterpenlactone gefunden.[10] Zudem besitzen diese Verbindungen die Eigenschaft, an Thiolgruppen binden zu können. Dadurch ist eine Interaktion der Verbindungen mit Aminosäuren wie Cystein und Proteinen mit freien SH-Gruppen nicht ausgeschlossen. Solche Proteine könnten z. B. Proteine der AUXIN RESISTANT1- und/oder der PIN-Familie sein, die maßgeblich am polaren Auxin-Transport beteiligt sind und damit am Auxin-abhängigen Streckungswachstum.[11] Die Inhibierung des abwärts gerichteten Auxintransports wurde in Versuchen durch das Auftragen von Dehydrocostuslacton an Hypokotylen von Raphanus gezeigt.[12] Die Sesquiterpenlactone sind ein charakteristisches Merkmal von Asteraceae, kommen aber auch in anderen Pflanzenfamilien vor. Sie sind potenzielle Kandidaten für Pflanzenhormone und besitzen vielfältige Wirkungen.
Abbau
[Bearbeiten | Quelltext bearbeiten]Auxine werden von Enzymen (Peroxidasen) und UV-Strahlen abgebaut, was jedoch nur eine sehr geringe Rolle spielt. Der genau Reaktionsablauf des enzymatischen Abbaus ist noch unbekannt. Diskutiert werden IAA-Oxidasen, die IAA von der Seitenkette her abbauen und ein Abbau über die Spaltung des Indolkernes.
Nachweis
[Bearbeiten | Quelltext bearbeiten]Der Nachweis und die quantitative Bestimmung von Auxinen erfolgte früher meist durch spezifische Biotestsysteme, zum Beispiel den Haferkoleoptilen-Krümmungstest. Heutzutage werden Gaschromatographie bzw. Gaschromatographie/Massenspektrometrie sowie Immunassays zur Auxin-Analytik eingesetzt.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Indol-3-essigsäure und vor allem einige synthetische Auxine wie 2,4-D haben als Wachstumsregulatoren in der Landwirtschaft sowie im Obst- und Gartenbau (Fruchtausdünnung, Förderung des Fruchtansatzes) breite Anwendung gefunden. Beispiele sind hier die Stecklingsbewurzelung oder als selektiv wirkende Herbizide im Getreideanbau, Winterraps-, Baumwoll-, Sojabohnen- und Zuckerrübenkulturen. Militärisch wurde der Butylester der 2,4,5-Trichlorphenoxyessigsäure im Vietnamkrieg als „Agent Orange“ zur Entlaubung benutzt. Die Schädigungen von Personen am Boden und bei den Flugzeugmannschaften beruhten auf der Kontamination durch polychlorierte Dibenzodioxine und Dibenzofurane.
Auxine spielen eine wichtige Rolle bei der Baumwollfaserentwicklung. Forschern der Universität Südwestchinas in Chongqing gelang mithilfe der Gentechnik eine Erhöhung der IAA-Produktion in der Epidermis der Pflanze zu Beginn des Faserwachstums. Dies führt zu einer Zunahme der Zahl und Länge verwendbarer Fasern (Lint) und einer Abnahme der Zahl der nicht zu Textilien verarbeitbaren Fasern (Linter). Feldversuche über vier Jahre ergaben, dass der Lintertrag bei den transgenen Pflanzen konsistent um mehr als 15 % höher war als bei den konventionellen Kontrollgruppen. Zudem verbesserte sich die Feinheit der Fasern.[13][14]
In Kombination mit Gibberellinen werden Auxine als Behandlungsmittel für Tafeltrauben verwendet. Folge sind große, kernlose Beeren. Ebenfalls werden Auxine aufgrund der achsenknospen-hemmenden und wurzelfördernden Wirkung zu Ertragssteigerung von Cannabispflanzen verwendet. Ist jedoch der gegenteilige Effekt erwünscht (z. B. zur Gewinnung von Vermehrungsmaterial, wo die Knospenbildung ausdrücklich erwünscht ist) werden stattdessen die antagonistisch wirkenden Zytokinine verwendet.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Klaus Grossmann, Hauke Hansen: Auxin-Herbizide: Wirkstoffe mit Janusgesicht. Biologie in unserer Zeit 33 (1), S. 12–20 (2003).
- Lincoln Taiz und Eduardo Zeiger: Plant Physiology – Das Original mit Übersetzungshilfen. Spektrum Akademischer Verlag; 4. Auflage 2007; ISBN 978-3-8274-1865-4.
- Vanneste, S. und Friml, J. (2009): Auxin: a trigger for change in plant development. In: Cell 136 (6); 1005–1016; PMID 19303845; doi:10.1016/j.cell.2009.03.001
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Botanik online: Peter von Sengbusch († 2002): Auxine
- Genetischer Schalter reguliert Pflanzenentwicklung. Bei der Entwicklung von der Keimzelle zur Pflanze kommt dem Pflanzenhormon Auxin die Funktion eines genetischen Schalters zu. In: pflanzenforschung.de. 20. April 2011, abgerufen am 24. November 2020.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Kiyoshi Mashiguchi, Keita Tanaka, Tatsuya Sakai, Satoko Sugawara, Hiroshi Kawaide: The main auxin biosynthesis pathway in Arabidopsis. In: Proceedings of the National Academy of Sciences. Band 108, Nr. 45, 8. November 2011, S. 18512–18517, doi:10.1073/pnas.1108434108, PMID 22025724, PMC 3215075 (freier Volltext).
- ↑ Jan Petrášek, Jozef Mravec, Rodolphe Bouchard, Joshua J. Blakeslee, Melinda Abas: PIN Proteins Perform a Rate-Limiting Function in Cellular Auxin Efflux. In: Science. Band 312, Nr. 5775, 12. Mai 2006, S. 914–918, doi:10.1126/science.1123542, PMID 16601150.
- ↑ Kiyoshi Mashiguchi, Keita Tanaka, Tatsuya Sakai, Satoko Sugawara, Hiroshi Kawaide: The main auxin biosynthesis pathway in Arabidopsis. In: Proceedings of the National Academy of Sciences. Band 108, Nr. 45, 8. November 2011, S. 18512–18517, doi:10.1073/pnas.1108434108, PMID 22025724, PMC 3215075 (freier Volltext).
- ↑ Eric D. Brenner, Rainer Stahlberg et al.: Plant neurobiology: an integrated view of plant signaling. Trends in Plant Science 11 (8), 2006, S. 413–419
- ↑ Goeschl, J.D., Rappaport, L., Pratt, H.K. (1966) Ethylene as a factor regulating the growth of pea epicotyls subjected to physical stress. Plant Physiol. 41, S. 877–884.
- ↑ Eva L. Decker, Wolfgang Frank, Eric Sarnighausen, Ralf Reski (2006): Moss systems biology en route: Phytohormones in Physcomitrella development. Plant Biology 8, 397–406. doi:10.1055/s-2006-923952
- ↑ Kaori Yokotani-Tomita, Jun Kato, Kosumi Yamada, Seiji Kosemura, Shosuke Yamamura: 8-Epixanthatin, a light-induced growth inhibitor, mediates the phototropic curvature in sunflower (Helianthus annuus) hypocotyls. In: Physiologia Plantarum. Band 106, Nr. 3, Juli 1999, S. 326–330, doi:10.1034/j.1399-3054.1999.106310.x.
- ↑ Otmar Spring, Achim Hager: Inhibition of elongation growth by two sesquiterpene lactones isolated from Helianthus annuus L. In: Planta. Band 156, Nr. 5, Dezember 1982, S. 433–440, doi:10.1007/bf00393314.
- ↑ J. BRUINSMA, C.M. KARSSEN, M. BENSCHOP, J.B. VAN DORT: Hormonal Regulation of Phototropism in the Light-grown Sunflower Seedling,Helianthus annuusL.: Immobility of Endogenous Indoleacetic Acid and Inhibition of Hypocotyl Growth by Illuminated Cotyledons. In: Journal of Experimental Botany. Band 26, Nr. 3, 1975, S. 411–418, doi:10.1093/jxb/26.3.411.
- ↑ SHIBAOKA, HIROH: STUDIES ON THE MECHANISM OF GROWTH INHIBITING EFFECT OF LIGHT. In: Plant and Cell Physiology. Band 2, Nr. 2, Mai 1961, doi:10.1093/oxfordjournals.pcp.a077675 (oup.com [abgerufen am 24. September 2018]).
- ↑ Junichi Ueda, Yuta Toda, Kiyotaka Kato, Yuichi Kuroda, Tsukasa Arai: Identification of dehydrocostus lactone and 4-hydroxy-β-thujone as auxin polar transport inhibitors. In: Acta Physiologiae Plantarum. Band 35, Nr. 7, 29. März 2013, S. 2251–2258, doi:10.1007/s11738-013-1261-6.
- ↑ Junichi Ueda, Yuta Toda, Kiyotaka Kato, Yuichi Kuroda, Tsukasa Arai: Identification of dehydrocostus lactone and 4-hydroxy-β-thujone as auxin polar transport inhibitors. In: Acta Physiologiae Plantarum. Band 35, Nr. 7, 29. März 2013, S. 2251–2258, doi:10.1007/s11738-013-1261-6.
- ↑ Mi Zhang, Xuelian Zheng, Shuiqing Song, Qiwei Zeng, Lei Hou, Demou Li, Juan Zhao, Yuan Wei, Xianbi Li, Ming Luo, Yuehua Xiao, Xiaoying Luo, Jinfa Zhang, Chengbin Xiang & Yan Pei: Spatiotemporal manipulation of auxin biosynthesis in cotton ovule epidermal cells enhances fiber yield and quality. Nature Biotechnology, Band 29, S. 453–458. doi:10.1038/nbt.1843
- ↑ Z Jeffrey Chen & Xueying Guan: Auxin boost for cotton. Nature Biotechnology, Band 29, S. 407–409. doi:10.1038/nbt.1858
